题目内容
16.判断下列离子方程式正确的是( )| A. | 铜与稀硝酸的反应:Cu+4H++2NO3-→Cu2++2NO2↑+2H2O | |
| B. | 稀NaOH溶液中滴加少量NH4Cl溶液:OH-+NH4+→NH3?H2O | |
| C. | 硫酸铵溶液与氢氧化钡溶液反应:OH-+NH4++SO42-+Ba2+→NH3↑+H2O+BaSO4↓ | |
| D. | FeS溶于稀HNO3:FeS+H+→Fe2++H2S↑ |
分析 A.铜与稀硝酸反应生成的是NO气体;
B.氢氧化钠与氯化铵反应生成氯化钠和一水合氨;
C.氢氧根离子、铵根离子的计量数错误,其生成一水合氨;
D.稀硝酸具有强氧化性,能够氧化FeS.
解答 解:A.铜与稀硝酸的反应生成硝酸铜、一氧化氮气体和水,正确的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故A错误;
B.稀NaOH溶液中滴加少量NH4Cl溶液,反应生成一水合氨和氯化铵,反应的离子方程式为:OH-+NH4+=NH3•H2O,故B正确;
C.硫酸铵溶液与氢氧化钡溶液反应生成一水合氨和硫酸钡沉淀,正确的离子方程式为:2OH-+2NH4++SO42-+Ba2+=2NH3•H2O+BaSO4↓,故C错误;
D.FeS溶于稀HNO3,二者发生氧化还原反应,正确的离子方程为:NO3-+FeS+4H+=Fe3++S+NO↑+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.下列反应中,反应物总能量低于生成物总能量,且属于氧化还原反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 铝与稀盐酸 | D. | 铝粉与氧化铁粉末反应 |
14.如图是滴定管和量筒的两个液面.下列有关读数中正确的是( )
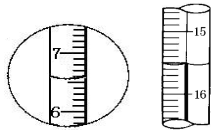

| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
4.下列实验操作能达到实验目的是( )
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |
1.合成结构简式 的高聚物,其单体应是( )
的高聚物,其单体应是( )
①苯乙烯
②丁烯
③1,3-丁二烯
④丙炔
⑤苯丙烯.
 的高聚物,其单体应是( )
的高聚物,其单体应是( )①苯乙烯
②丁烯
③1,3-丁二烯
④丙炔
⑤苯丙烯.
| A. | ①② | B. | ①③ | C. | ④⑤ | D. | ② |
8.金属钒主要用于冶炼特种钢和在化学工业、炼油工业中作催化剂,被誉为“合金的维生素”.回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如图所示.

(1)粉碎的作用是提高VOSO4(可溶性钒化合物)的浸出率,滤渣可用于制作光导纤维、建筑材料等(填用途).
(2)25时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表所示:
根据表数据判断,加入氨水调节溶液pH的最佳选择为1.7-1.8;上述过滤操作过程中所需用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中还原产物和氧化产物的物质的量之比为2:1.
(4)完成并配平氧化过程中的离子方程式:
1ClO3-+6VO2++6H+=6VO3++1Cl-+3H2O.
(5)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5).取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是95.55%.

(1)粉碎的作用是提高VOSO4(可溶性钒化合物)的浸出率,滤渣可用于制作光导纤维、建筑材料等(填用途).
(2)25时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表所示:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 9.8 | 96.4 | 93.0 | 89.3 |
(3)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中还原产物和氧化产物的物质的量之比为2:1.
(4)完成并配平氧化过程中的离子方程式:
1ClO3-+6VO2++6H+=6VO3++1Cl-+3H2O.
(5)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5).取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1mol•L-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是95.55%.
6.利用废碱渣(主要成分是Na2CO3)处理硫酸厂尾气中的SO2可制得无水Na2SO3(成品),其流程如图1:

(1)若欲利用废碱渣充分吸收SO2,则“吸收塔”内发生的主要反应的离子方程式为CO32-+2SO2+H2O═CO2+2HSO3-.
(2)处理过程中,要通过检验“吸收塔”排放出的尾气是否含有SO2来确定其是否达标.实验室中欲模拟检验尾气中的SO2,可以选用的试剂有bd;
a.澄清石灰水 b.硝酸酸化的Ba(NO3)2溶液 c.盐酸酸化的BaCl2溶液 d.品红溶液
(3)常温下,向“中和器”中加入适量NaOH后,溶液呈中性,则溶液中c(SO32-):c(HSO3-)=0.63[已知:常温下,Ka1(H2SO3)=l.5×10-2,Ka2(H2SO3)=6.3×10-8];
(4)图2所示为亚硫酸钠的溶解度曲线,则上述流程中的“结晶”方法是蒸发结晶(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为浊液;
(5)仅用BaCl2和H2O2的混合溶液难以检出“成品“中的SO32-,原因是“成品”中含有某种杂质阴离子,该杂质阴离子SO42-(填化学式);实验室中常用如下方法检验SO32-:

己知25℃时,部分钡盐的Ksp数值如表:
若“溶液A”中SO32-浓度为0.01mol•L-1,且为杂质阴离子浓度的10倍,则向其中加入等体积0.01mol•L-1BaCl2溶液充分反应后c(Ba2+)=7×10-4mol•L-1,向“溶液B”中滴入BaCl2和H2O2的混合溶液时,发生反应的离子方程式为Ba2++H2O2+HSO3-═BaSO4↓+H++H2O.

(1)若欲利用废碱渣充分吸收SO2,则“吸收塔”内发生的主要反应的离子方程式为CO32-+2SO2+H2O═CO2+2HSO3-.
(2)处理过程中,要通过检验“吸收塔”排放出的尾气是否含有SO2来确定其是否达标.实验室中欲模拟检验尾气中的SO2,可以选用的试剂有bd;
a.澄清石灰水 b.硝酸酸化的Ba(NO3)2溶液 c.盐酸酸化的BaCl2溶液 d.品红溶液
(3)常温下,向“中和器”中加入适量NaOH后,溶液呈中性,则溶液中c(SO32-):c(HSO3-)=0.63[已知:常温下,Ka1(H2SO3)=l.5×10-2,Ka2(H2SO3)=6.3×10-8];
(4)图2所示为亚硫酸钠的溶解度曲线,则上述流程中的“结晶”方法是蒸发结晶(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为浊液;
(5)仅用BaCl2和H2O2的混合溶液难以检出“成品“中的SO32-,原因是“成品”中含有某种杂质阴离子,该杂质阴离子SO42-(填化学式);实验室中常用如下方法检验SO32-:

己知25℃时,部分钡盐的Ksp数值如表:
| BaCO3 | BaSO4 | BaSO3 | BaS2O3 |
| 5.1×10-9 | 1.1×10-10 | 8.4×10-7 | 1.6×10-5 |