题目内容
5.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据).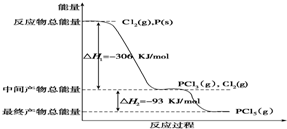
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g);△H=-306kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ•mol-1.
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因两步反应均为放热反应,降低温度有利于提高产率,防止产物分解.
(4)P和Cl2分两步反应生成1 mol PCl5的△H3=-399kJ•mol-1,P和Cl2一步反应生成1 mol PCl5的△H4等于△H3(填“大于”“小于”或“等于”).
分析 根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用,
(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306kJ的能量;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动;
(4)根据盖斯定律:化学反应不管是一步完成,还是分步完成,其化学反应的焓变是一定的.
解答 解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306kJ的能量,
则反应的热化学方程式为P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g);△H=-306kJ•mol-1,
故答案为:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g);△H=-306kJ•mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ•mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ•mol-1;
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解;
(4)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ•mol-1;等于.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

| A. | H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol |
| A. | HCOOH是还原剂 | B. | ClSO3H被还原 | ||
| C. | 反应后溶液的酸性增强 | D. | ClSO3H是离子化合物 |
| A. | 改变压强不可以改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率 | |
| C. | 增大压强能增大反应速率 | |
| D. | 升高温度能增大反应速率 |
| A. | 蒸馏 | B. | 萃取 | C. | 电解水 | D. | 蒸发 |
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe3++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | Na2SO4溶液与BaCl2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
| 组别 | 镁铝合金质量/g | HCl溶液体积/mL | 气体的体积/L |
| 甲 | 2.55 | 400 | 2.80 |
| 乙 | 3.85 | 400 | 3.36 |
| 丙 | 4.59 | 400 | 3.36 |
(1)求得的盐酸物质的量浓度是0.75mol/L;
(2)求得镁、铝的物质的量之比是1:1.
(3)在丙组实验之后向容器中加入1mol•L-1的氢氧化钠溶液,使剩余固体中无铝元素,求所加氢氧化钠溶液的体积.(写计算过程).
 ,取代反应
,取代反应 ,取代反应
,取代反应