题目内容
19.合成导电高分子材料PPV的反应: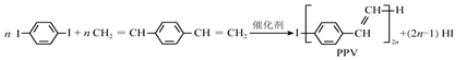
下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | H2C═CH CH═CH2和苯乙烯互为同系物 CH═CH2和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
分析 A.缩聚反应,是一类有机化学反应,是具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如 H2O、HX、醇等)的化学反应;
B.聚苯乙烯的重复结构单元为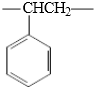 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
C.同系物所含官能团数目相同;
D.质谱仪能记录分子离子、碎片离子的相对质量.
解答 解:A.合成PPV通过缩聚反应生成,同时有小分子物质HI生成,不属于加聚反应,故A错误;
B.聚苯乙烯的重复结构单元为 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
C.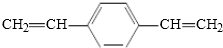 有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
D.质谱仪能记录分子离子、碎片离子的相对质量,质谱图中数值最大的即是该分子的相对分子质量,故D正确.
故选D.
点评 本题主要考查有机物的结构和性质,侧重于学生的分析能力的考查,注意明确聚合反应原理,选项B为易错点,找准链节是解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1 molN2与4 mol H2在一定条件下反应生成NH3的分子数为2NA | |
| B. | 标准状况下,5.6LSO3中含有的原子总数为NA | |
| C. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| D. | 常温下,4.6g NO2 和N2O4的混合物中氧原子数为0.2NA |
14.用H2可将工业废气中的NO催化还原成N2,其它量的转化关系如图所示(图中计量单位为mol),则:
NO(g)+H2(g)=$\frac{1}{2}$N2(g)+H2O(g)的△H为( )
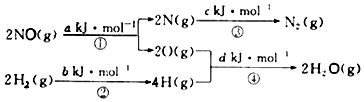
NO(g)+H2(g)=$\frac{1}{2}$N2(g)+H2O(g)的△H为( )

| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
4. 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
(1)硅元素基态原子的价电子轨道表示式为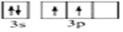 .
.
(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.(1)硅元素基态原子的价电子轨道表示式为
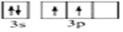 .
.(2)第四周期中,与铝未成对电子数相同的金属元素有4种.
(3)Na+和Ne互为等电子体,电离能I2(Na)> I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为HF分子与水分子间存在氢键,电离时需要更多能量,影响△H2递变的因素为键能.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为$\frac{4M}{{N}_{A}×{q}^{3}×1{0}^{-21}}$ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为$\frac{4×\frac{4}{3}π{r}^{3}}{{q}^{3}×1{0}^{9}}$.
8. 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5kJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076kJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490kJ的能量
请回答下列问题:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=b.(选填“>”“<”或“=”)
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
①T2℃时,容器1中反应的平衡常数K1=64.
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是CD(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率a1<a2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图所示.
6min时,改变的外界条件为升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5kJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076kJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490kJ的能量
请回答下列问题:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=b.(选填“>”“<”或“=”)
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是CD(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率a1<a2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图所示.
6min时,改变的外界条件为升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
16.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Cu2+、Na+、SO42-、OH- | D. | Ba2+、SO32-、NO3-、K+ |
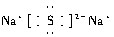 .
.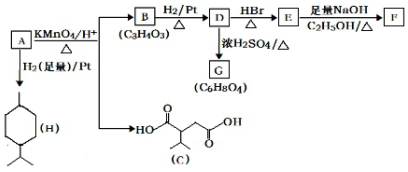
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$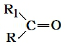 +R2COOH
+R2COOH .
. .
.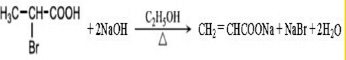 .
.