题目内容
17.某学习小组按如下实验过程测量海带中碘的含量
上述实验过程对仪器选择不合理的是( )
| A | B | C | D |
 Ⅰ |  Ⅱ |  Ⅲ |  Ⅳ |
| A. | A | B. | B | C. | C | D. | D |
分析 过程Ⅰ固体物质的灼烧应该在坩埚中进行;过程Ⅱ进行固液混合物的过滤应该使用过滤装置;实验Ⅲ配置一定体积一定浓度的溶液应该在容量瓶中进行;实验Ⅳ进行滴定的试验应该实用滴定管进行试验.
解答 解:A、过程Ⅰ固体物质的灼烧应该在坩埚中进行,故A正确;
B、过程Ⅱ进行固液混合物的过滤应该使用过滤装置,注意:一贴二低三靠的原理,故B正确;
C、实验Ⅲ配置一定体积一定浓度的溶液应该在容量瓶中进行一个分液操作,此装置用于互不相溶物质的分离,故C错误;
D、实验Ⅳ进行滴定的试验应该实用滴定管进行试验,故D正确.
故选C.
点评 本题考查了实验操作过程,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,题目较简单.

练习册系列答案
相关题目
8. 麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示.下列有关麦考酚酸说法不正确的是( )
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示.下列有关麦考酚酸说法不正确的是( )
 麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示.下列有关麦考酚酸说法不正确的是( )
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示.下列有关麦考酚酸说法不正确的是( )| A. | 分子式为C17H22O6 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol麦考酚酸最多能与3mol NaOH反应 | |
| D. | 1mol麦考酚酸最多能与4mol H2发生加成反应 |
5.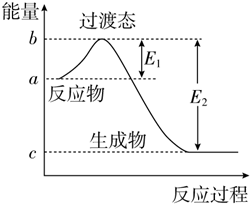 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
12.发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂.
(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
则使l mol N2O4(1)分子中化学键完全断裂时需要吸收的能量是1793kJ
(2)N2O4与NO2之间存在反应N2O4(g)?2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有减小体系压强、移出NO2(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点.
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为N2H4+2O2-4e-=N2+2H2O.
②a极与N(填“M”或“N”)相连,写出N极电极反应式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1.5mol.

(1)肼(N2H4)与N2O4的反应为:2N2H4(g)+N2O4(1)═3N2(g)+4H2O(g)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如表:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
(2)N2O4与NO2之间存在反应N2O4(g)?2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率,[aN2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),若要提高N2O4的转化率,除改变反应温度外,其它措施有减小体系压强、移出NO2(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强P0为108kPa,列式计算该温度下反应的平衡常数.Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数.相应的速率-压强关系如图2所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点.
(3)某科研人员设计如图3甲所示新型燃料电池,已知固体电解质可以传导O2-,生成物均为无毒无害的物质.将燃料电池的正负两极与装置乙中M、N两惰性电极连接,两极室均可产生乙醛酸(HOOC-CHO).其中M电极区的乙二醛(OHC-CHO)与电极产物发生反应生成乙醛酸.则:
①燃料电池负极的电极反应式为N2H4+2O2-4e-=N2+2H2O.
②a极与N(填“M”或“N”)相连,写出N极电极反应式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
③若有1.5mol H+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1.5mol.
9.某含铬Cr2O72- 废水用硫亚铁铵[FeSO4•(NH4)2 SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n molFeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
| A. | 在FeO•FeyCrxO3中3x=y | |
| B. | 消耗硫酸亚铁铵的物质量为n(2-x)mol | |
| C. | 反应中发生转移的电子数为3nx mol | |
| D. | 处理废水中Cr2O72- 的物质量为$\frac{nx}{2}$mol |

 .
. .
. .
.