题目内容
15.下列说法不正确的是( )| A. | 用丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液 | |
| B. | 配制100g 20%的硝酸钾溶液,需要用到容量瓶 | |
| C. | 可以用萃取的方法将溴从溴水中提取出来 | |
| D. | 焰色反应实验前,应先用稀盐酸洗净铂丝,再在酒精灯上灼烧至无色 |
分析 A.丁达尔效应为胶体特有的性质;
B.配制100g 20%的硝酸钾溶液,计算、称量后在烧杯中溶解即可;
C.溴不易溶于水,易溶于有机溶剂;
D.焰色反应实验前,应先用稀盐酸洗净铂丝,灼烧时盐酸挥发,不干扰实验.
解答 解:A.丁达尔效应为胶体特有的性质,则丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液,故A正确;
B.配制100g 20%的硝酸钾溶液,计算、称量后在烧杯中溶解即可,需要托盘天平、烧杯、玻璃棒、量筒,不需要容量瓶,故B错误;
C.溴不易溶于水,易溶于有机溶剂,则萃取的方法将溴从溴水中提取出来,故C正确;
D.焰色反应实验前,应先用稀盐酸洗净铂丝,灼烧时盐酸挥发,不干扰实验,再在酒精灯上灼烧至无色,然后进行焰色反应实验,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的鉴别、溶液配制、混合物分离提纯、焰色反应为解答本题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
5.制取纯净的一氯乙烷最好采用的方法是( )
| A. | 乙烷和 Cl2反应 | B. | 乙烯和 Cl2反应 | ||
| C. | 乙烯和 HCl 反应 | D. | 乙烯和 H2、Cl2 反应 |
6.含有Na+浓度为0.5mol•L-1某无色透明澄清溶液中,还可能含有表中的若干种离子.
已知:
①H2SiO3为不溶于水的胶状沉淀,加热时分解为两种氧化物;
②CaSiO3 BaSiO3不溶于水.
现取该溶液100mL进行如下实验:
回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是Ca2+、Ba2+
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O
(3)据实验Ⅲ可知一定不存在的离子是SO42-
(4)某同学认为该溶液中一定存在K+,其理由是若无钾离子,阴离子带的电荷总数大于阳离子所带的电荷总数;据上述数据,c(K+)应不小于0.8mol/L.
| 阳离子 | K+ | Fe2+ | Ca2+ | Ba2+ |
| 阴离子 | NO3- | CO3-2 | SiO32- | SO42- |
①H2SiO3为不溶于水的胶状沉淀,加热时分解为两种氧化物;
②CaSiO3 BaSiO3不溶于水.
现取该溶液100mL进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ca2+、Ba2+
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O
(3)据实验Ⅲ可知一定不存在的离子是SO42-
(4)某同学认为该溶液中一定存在K+,其理由是若无钾离子,阴离子带的电荷总数大于阳离子所带的电荷总数;据上述数据,c(K+)应不小于0.8mol/L.
3.已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
10.下列现象不能用“相似相溶”解释的是( )
| A. | 氯化氢易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
20.下列基本实验操作中,不合理的是( )
| A. | 配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm,改用胶头滴管定容 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子 | |
| D. | 分液操作,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
7.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示,Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
| X | Y | ||
| Z | W |
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由小到大的顺序为:X<Y<W<Z | |
| C. | 与同浓度的盐酸反应,Z比W更剧烈 | |
| D. | X的气态氢化物的稳定性比Y的高 |
4.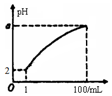 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A. | a的取值范围为2<a<4 | |
| B. | HA溶液加热时,溶液酸性增强 | |
| C. | 与pH=12的NaOH溶液等体积混合后溶液的pH=7 | |
| D. | HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |