题目内容
10.向NaCN溶液中通入少量CO2,反应的化学方程式为NaCN+CO2=NaHCO3+HCN.分析 碳酸酸性强于HCN,NaCN与二氧化碳反应生成NaHCO3和HCN,据此解答.
解答 解:碳酸酸性强于HCN,NaCN与二氧化碳反应生成NaHCO3和HCN,化学方程式:NaCN+CO2=NaHCO3+HCN;
故答案为:NaCN+CO2=NaHCO3+HCN;
点评 本题考查了化学方程式的书写,明确强酸制备弱酸的规律,熟悉碳酸与HCN酸性强弱是解题关键,题目难度不大.

练习册系列答案
相关题目
20.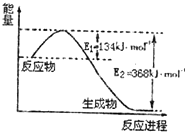 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
完成下列问题:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
1.反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
①反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
18.关于蛋白质的下列说法正确的是( )
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
5.在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L-1,在一定条件下发生反应:A(g)+B(g)?2C(g).该温度下,此反应的平衡常数为4,则A的转化率为( )
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
15.下列说法不正确的是( )
| A. | 盐的组成中不一定含有金属元素 | |
| B. | 强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 | |
| C. | 同种元素在不同的化合物中的化合价不一定相同 | |
| D. | 由同种元素组成的物质一定是单质 |
2.向某密闭容器中加入0.3molA、0.1molC 和一定量的 B 三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段 c ( B)未画出].附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
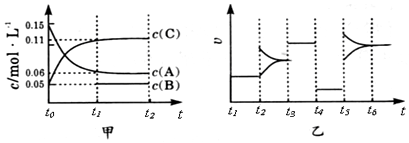

| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
19.在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2?2NH3.在一定温度下达到平衡,H2的转化率为20%.若在同一容器中充入NH3,欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是( )
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
20.关于下列各装置图的叙述中,正确的是( )
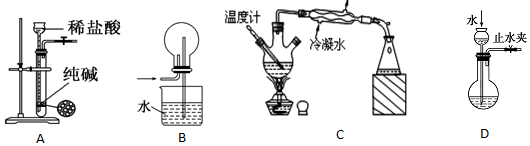

| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |