题目内容
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
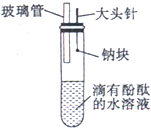
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生无色气体 |
| ④镁带与2mol?L-1的盐酸反应 | (D)剧烈反应,产生无色气体 |
| ⑤铝条与2mol?L-1的盐酸反应 | (E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(1)实验目的:______.
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管、滤纸
药品:镁带、钠、铝条、新制氯水、新制饱和硫化氢溶液、2mol?L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液
(3)实验内容:(填写题给信息表中的序号)
| 实验方案 | 实验现象(填写序号) |
| ① | ______ |
| ② | ______ |
| ③ | ______ |
| ④ | ______ |
| ⑤ | ______ |
| ⑥ | ______ |
(5)请你补充简单易行的实验方案,证明此周期中另外两种元素的性质递变规律.______.
解:(1)根据实验方案知,实验①③④⑤⑥是想证明金属的金属性强弱,且这几种金属都是同一周期的金属,实验2是想证明非金属性强弱的,即实验目的为探究同周期元素性质的递变规律,故答案为:验证第三周期元素从左到右金属性递减、非金属性递增的规律;
(3)①镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢气是可燃性气体,且氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,所以溶液呈浅红色,故选B.
②氯气和硫化氢反应生成硫单质和水,硫单质不易溶于水,且硫单质呈淡黄色,所以会看到有淡黄色沉淀生成,故选F.
③钠与滴有酚酞试液的冷水反应,钠的密度小于水的密度,所以会浮在水面上;钠的熔点较低,钠和水反应放出大量热,钠和水反应很剧烈,生成氢氧化钠和氢气,氢气是可燃性气体,氢氧化钠是易溶于水的碱,所以其水溶液呈红色,故选A.
④镁带与2mol.L-1的盐酸反应,盐酸中氢离子浓度较大,所以反应剧烈,产生可燃性气体,故选D.
⑤铝条与2mol.L-1的盐酸反应,盐酸和铝反应不如和镁反应剧烈,且反应时都生成可燃性气体,故选C.
⑥向AlCl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,加入NaOH至过量,继续反应生成NaAlO2而溶解,故选E.
故答案为:①B;②F;③A;④D;⑤C;⑥E;
(4)由实验可知金属性Na>Mg>Al,非金属性Cl>S,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强,
故答案为:金属性:Na>Mg>Al;非金属性:Cl>S;
(5)此周期中另外两种元素为Si和P,可在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀.判断两种最高价含氧酸的酸性:磷酸强于硅酸,则磷非金属性强于硅,
故答案为:在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀.判断两种最高价含氧酸的酸性:磷酸强于硅酸,则磷非金属性强于硅.
分析:(1)实验涉及Na、Mg、Al、S、Cl第三周期元素对应化合物的性质的递变规律;
(3)根据生成物的颜色、状态、溶液的酸碱性选取相应的实验现象;
(4)根据实验现象来分析实验的结论,涉及铜周期元素金属性、非金属性的递变规律;
(5)此周期中另外两种元素为Si和P,可通过比较最高价氧化物对应水化物的酸性强弱比较非金属性强弱.
点评:本题考查学生利用实验来验证同周期元素性质的变化规律,明确现象和结论的关系及原子结构和性质的关系是解答本题的关键,题目难度中等.
(3)①镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢气是可燃性气体,且氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,所以溶液呈浅红色,故选B.
②氯气和硫化氢反应生成硫单质和水,硫单质不易溶于水,且硫单质呈淡黄色,所以会看到有淡黄色沉淀生成,故选F.
③钠与滴有酚酞试液的冷水反应,钠的密度小于水的密度,所以会浮在水面上;钠的熔点较低,钠和水反应放出大量热,钠和水反应很剧烈,生成氢氧化钠和氢气,氢气是可燃性气体,氢氧化钠是易溶于水的碱,所以其水溶液呈红色,故选A.
④镁带与2mol.L-1的盐酸反应,盐酸中氢离子浓度较大,所以反应剧烈,产生可燃性气体,故选D.
⑤铝条与2mol.L-1的盐酸反应,盐酸和铝反应不如和镁反应剧烈,且反应时都生成可燃性气体,故选C.
⑥向AlCl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,加入NaOH至过量,继续反应生成NaAlO2而溶解,故选E.
故答案为:①B;②F;③A;④D;⑤C;⑥E;
(4)由实验可知金属性Na>Mg>Al,非金属性Cl>S,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强,
故答案为:金属性:Na>Mg>Al;非金属性:Cl>S;
(5)此周期中另外两种元素为Si和P,可在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀.判断两种最高价含氧酸的酸性:磷酸强于硅酸,则磷非金属性强于硅,
故答案为:在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀.判断两种最高价含氧酸的酸性:磷酸强于硅酸,则磷非金属性强于硅.
分析:(1)实验涉及Na、Mg、Al、S、Cl第三周期元素对应化合物的性质的递变规律;
(3)根据生成物的颜色、状态、溶液的酸碱性选取相应的实验现象;
(4)根据实验现象来分析实验的结论,涉及铜周期元素金属性、非金属性的递变规律;
(5)此周期中另外两种元素为Si和P,可通过比较最高价氧化物对应水化物的酸性强弱比较非金属性强弱.
点评:本题考查学生利用实验来验证同周期元素性质的变化规律,明确现象和结论的关系及原子结构和性质的关系是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.