题目内容
7.下列病症是由于缺乏什么元素引起的?(1)夜盲症:维生素A;
(2)佝偻病:维生素D
(3)牙床溃烂、牙齿松动:维生素C
(4)贫血铁
(5)甲状腺肿大碘.
分析 根据维生素和微量元素在人体内的作用来分析,常见的由于维生素缺乏导致的病症有夜盲症、佝偻病和口腔溃疡等,据此分析.
解答 解:(1)夜盲症是由于缺乏维生素A引起的,故答案为:维生素A;
(2)佝偻病是由于缺乏维生素D、从而引起钙的吸收不好引起的,故答案为:维生素D;
(3)牙床溃烂、口腔溃疡和牙齿松动等是由于 维生素C的缺乏引起的,故答案为:维生素C;
(4)缺铁性贫血是由于铁元素的缺乏引起的,故答案为:铁;
(5)甲状腺肿大是由于碘元素的缺乏引起的,故答案为:碘.
点评 本题考查了维生素和微量元素在人体中的重要作用,难度不大,注意基础知识的识记.

练习册系列答案
相关题目
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1LC2H5OH燃烧后生成的CO2分子数约为$\frac{{N}_{A}}{11.2}$ | |
| B. | 电解食盐水水时,当产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 标准状况下,11.2LCH4和C2H4混合气体中含有碳原子的数目为2NA | |
| D. | NH3易溶于水,3.4gNH3溶于1LH2O,溶液中氮原子总数为0.6NA |
16.KMnO4能将草酸(H2C2O4)氧化.在25℃下,某同学欲通过对比实验探究初始pH和草酸浓度对该反应速率的影响.完成实验设计表,表中不要留空格.
(2)某同学欲利用高锰酸钾法测定碳酸钙样品中钙的含量.过程如下:
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
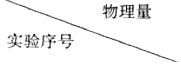 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
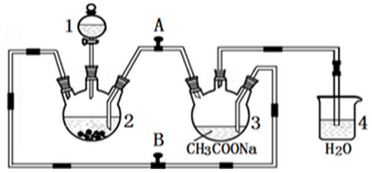
19. 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加液溴滴完.装置d的作用是吸收HBr和Br2;a中发生的化学反应方程式 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加液溴滴完.装置d的作用是吸收HBr和Br2;a中发生的化学反应方程式
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
加入氯化钙的目的是干燥;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
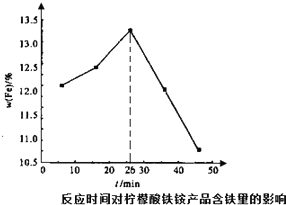 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下: