题目内容
6.下列事实一定能证明HNO2是弱电解质的是( )①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的 HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
| A. | ①④⑤⑥ | B. | ④⑤⑥⑦ | C. | ①②③④ | D. | 全部 |
分析 部分电离、溶液中存在电离平衡的电解质为弱电解质,利用酸不能完全电离或盐类水解的规律来分析HNO2是弱电解质.
解答 解:①常温下HNO2溶液的pH小于7,只能证明其为酸,不能证明其为弱酸,故①错误;
②溶液的导电性与离子浓度成正比,用HNO2溶液做导电实验,灯泡很暗,只能说明溶液中离子浓度很小,不能说明亚硝酸的电离程度,所以不能证明亚硝酸为弱电解质,故②错误;
③HNO2和NaCl不能发生反应,只能说明不符合复分解反应的条件,但不能说明是弱酸,故③错误;
④常温下0.1 mol•L-1 HNO2溶液的pH=2.1,说明亚硝酸不完全电离,溶液中存在电离平衡,所以能说明亚硝酸为弱酸,故④正确;
⑤强酸可以制取弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2的酸性弱于H3PO4,所以能说明亚硝酸为弱酸,故⑤正确;
⑥常温下pH=1的HNO2溶液稀释至100倍,pH约为2.8说明亚硝酸中存在电离平衡,则亚硝酸为弱电解质,故⑥正确;
⑦常温下亚硝酸钠溶液的pH大于7,说明亚硝酸钠为强碱弱酸盐,所以能说明亚硝酸为弱酸,故⑦正确;
故选B.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质,题目难度不大.

练习册系列答案
相关题目
1.类比归纳是学习化学的重要方法,对如下类比的说法正确的是( )
| A. | NO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色 | |
| B. | MgO、Al2O3都是高熔点离子化合物,都能用作耐热材料 | |
| C. | CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | CuO、Fe2O3都是不溶于水的碱性氧化物,都是黑色粉末 |
11.将足量HCl通入上述各溶液中,所含离子还能大量共存的是( )
| A. | K+、SO32-、Cl-、NO3- | B. | H+、NH4-、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Ca2+、CH3COO-、HCO3- |
18.将0.05molSO2(g)和0.03molO2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.02mol•L-1.以下表述正确的是( )
| A. | 该条件下反应的平衡常数为1.6×103 | |
| B. | 通常情况下,该反应一定能自发进行 | |
| C. | 题给条件下,SO2的转化率是80% | |
| D. | 当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
15. 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③它的同分异构体中有芳香族化合物
④1mol该有机物水解时只能消耗1molNaOH
⑤1mol该有机物在一定条件下能和3mol H2反应.
 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③它的同分异构体中有芳香族化合物
④1mol该有机物水解时只能消耗1molNaOH
⑤1mol该有机物在一定条件下能和3mol H2反应.
| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
16. 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是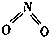 和
和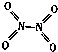 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
(1)写出N2O4转化NO2为的热化学方程式N2O4(g)?2NO2(g)△H=+57 kJ•mol-1.
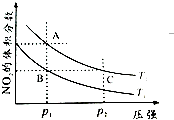
(2)对反应N2O4(g)?2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)<v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)=M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是加热.
④A点气体的颜色比C点浅(填“深”、“浅”或“相同”),原因是A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
①在上述条件下,从反应开始直至20s时,v(NO2)=0.0025mol•L-1•s-1.
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是0.10 mol•L-1.
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是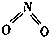 和
和 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.(1)写出N2O4转化NO2为的热化学方程式N2O4(g)?2NO2(g)△H=+57 kJ•mol-1.
(2)对反应N2O4(g)?2NO2(g),在温度T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
①A、C两点的反应速率v(A)<v(C)(填“>”“=”或“<”).
②B、C两点的气体平均相对分子质量M(B)=M(C)(填“>”、“=”或“<”).
③由状态B到达状态A可用的方法是加热.
④A点气体的颜色比C点浅(填“深”、“浅”或“相同”),原因是A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大.
(3)在100℃时,将0.40mol的NO2气体充入2L的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同的情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度应是0.10 mol•L-1.
