题目内容
下列有关物质的性质和用途的说法不正确的是( )
| A、自然界中没有游离态的硅,纯净的硅晶体可用于制作光导纤维 |
| B、可用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C、钢材是合金,合金的熔点低,硬度大 |
| D、用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质 |
考点:硅和二氧化硅,氯、溴、碘及其化合物的综合应用,合金的概念及其重要应用,钠的重要化合物
专题:元素及其化合物
分析:A.光导纤维的主要成分为二氧化硅;
B.碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳;
C.依据合金性能解答;
D.氢氟酸常温下能够与玻璃中的二氧化硅反应.
B.碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳;
C.依据合金性能解答;
D.氢氟酸常温下能够与玻璃中的二氧化硅反应.
解答:
解:A.二氧化硅是制光导纤维的主要原料,不是晶体硅,故A错误;
B.碳酸钠受热不分解;碳酸氢钠受热分解生成二氧化碳和水,故B正确;
C.合金性能优于成分金属,熔点低于成分金属,故C正确;
D.氢氟酸常温下能够与玻璃中的二氧化硅反应,能够腐蚀雕刻玻璃,故D正确;
故选:A.
B.碳酸钠受热不分解;碳酸氢钠受热分解生成二氧化碳和水,故B正确;
C.合金性能优于成分金属,熔点低于成分金属,故C正确;
D.氢氟酸常温下能够与玻璃中的二氧化硅反应,能够腐蚀雕刻玻璃,故D正确;
故选:A.
点评:本题考查了硅、二氧化硅、合金的性质,熟悉合金的性能是解题关键,注意合金熔点特点.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列实验能达到预期目的是( )
| A、检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B、检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
| C、检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液 |
| D、检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸 |
将Na2O2投入到FeCl2溶液中,观察到的现象是( )
| A、生成白色沉淀 |
| B、生成红褐色沉淀 |
| C、没有气泡产生 |
| D、溶液变成棕黄色 |
下列有关实验叙述正确的是( )
| A、除去苯中混有的苯酚可加入浓溴水后过滤 |
| B、向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
| C、向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 |
| D、向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 |
在下列物质的水溶液中分别加入澄清的石灰水后,原溶液中的阴离子和阳离子都减少的是( )
| A、FeCl2 |
| B、CuSO4 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
下列水溶液中,能大量共存的一组离子是( )
| A、Na+、H+、NO3-、SO32- |
| B、K+、H+、SO42-、CH3COO- |
| C、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Fe3+、Cl-、SCN- |
关于下列装置的说法正确的是( )
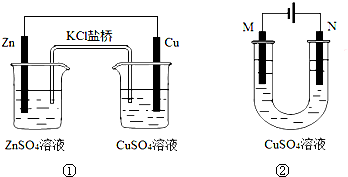

| A、装置①中盐桥内的K+移向CuSO4溶液 |
| B、装置①将电能转变为化学能 |
| C、若装置②用于铁棒镀铜,则N极为铁棒 |
| D、若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |