题目内容
下列实验能达到预期目的是( )
| A、检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B、检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
| C、检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液 |
| D、检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸 |
考点:常见阳离子的检验,常见阴离子的检验
专题:
分析:A、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫;
B、溶液中含有银离子也会出现此现象;
C、氯水具有氧化性,能氧化亚铁离子生成铁离子,铁离子与硫氰化钾反应出现血红色;
D、和氢氧化钠反应生成氨气的离子是铵根离子.
B、溶液中含有银离子也会出现此现象;
C、氯水具有氧化性,能氧化亚铁离子生成铁离子,铁离子与硫氰化钾反应出现血红色;
D、和氢氧化钠反应生成氨气的离子是铵根离子.
解答:
解:A、能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以向某溶液中加入稀HCl,放出能使澄清的石灰水变浑浊的气体,原溶液中不一定有碳酸根离子,可能有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子中的一种或几种,故A错误;
B、某溶液中滴加氯化钡溶液有白色沉淀产生,再加入稀硝酸,沉淀不消失,可能是含有银离子或硫酸根离子,故B错误;
C、铁离子与硫氰化钾反应出现血红色,故铁离子会干扰亚铁离子的检验,可先滴加硫氰化钾,若不出现红色,再滴加过氧化氢,若溶液变红,证明含亚铁离子,故C错误;
D、溶液中加入氢氧化钠溶液,加热后能产生使湿润的红色石蕊试纸变蓝的气体即氨气,则溶液中含有NH4+,故D正确;故选D.
B、某溶液中滴加氯化钡溶液有白色沉淀产生,再加入稀硝酸,沉淀不消失,可能是含有银离子或硫酸根离子,故B错误;
C、铁离子与硫氰化钾反应出现血红色,故铁离子会干扰亚铁离子的检验,可先滴加硫氰化钾,若不出现红色,再滴加过氧化氢,若溶液变红,证明含亚铁离子,故C错误;
D、溶液中加入氢氧化钠溶液,加热后能产生使湿润的红色石蕊试纸变蓝的气体即氨气,则溶液中含有NH4+,故D正确;故选D.
点评:本题考查了常见阴阳离子的检验,难度不大,注意B选项,和稀HCl放出能使澄清的石灰水变浑浊的气体的离子有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.下列分析正确的是( )
| A、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| B、通入SO2时,SO2与I2反应,I2作还原剂 |
| C、通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| D、滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是( )
| A、稀释后溶液的pH=7 | ||||
| B、氨水的电离度增大,溶液中所有离子的浓度均减小 | ||||
C、稀释过程中
| ||||
| D、pH=11氨水的浓度为0.001mol/L |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,5.6 LNO和16.8 LO2的混合气体中含有分子数为NA |
| B、0.1 mol Fe在氧气中充分燃烧失电子数为0.3NA |
| C、在1 L lmol?L-1的氨水中,含有的NH3与NH3?H2O分子的总数为NA |
| D、标准状况下,40gSO3所占的体积一定小于11.2 L |
下列说法正确的是( )
| A、2-甲基丙烷的一氯取代物有两种 |
B、 和 和 互为同系物 互为同系物 |
| C、顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 |
D、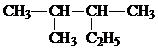 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
中国每年要进口5亿吨左右的铁矿石,占世界海上铁矿石贸易量的一半以上,关于铁矿石的说法正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁矿石的主要成分与铁锈的主要成分相同 |
| C、磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变血红色 |
| D、FeO俗称铁红 |
下列有关物质的性质和用途的说法不正确的是( )
| A、自然界中没有游离态的硅,纯净的硅晶体可用于制作光导纤维 |
| B、可用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C、钢材是合金,合金的熔点低,硬度大 |
| D、用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质 |
