题目内容
19.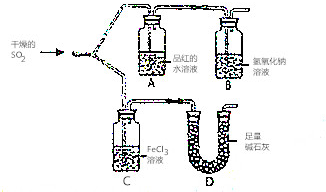 如图装置进行SO2气体性质实验
如图装置进行SO2气体性质实验(1)仪器D的名称是U形管;
(2)实验过程中,仪器A中的实验现象是品红溶液褪色;
(3)写出仪器C中发生氧化还原反应的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
分析 (1)依据仪器形状说出其名称;
(2)二氧化硫具漂白性,能使品红溶液褪色;
(3)二氧化硫具有还原性能被铁离子氧化为硫酸根离子.
解答 解:(1)依据形状可知:装置D中盛放碱石灰的仪器名称U形管;
故答案为:U形管;
(2)二氧化硫具漂白性,能使品红溶液褪色,A中盛放的是品红溶液,所以仪器A中的实验现象是品红溶液褪色;
故答案为:品红溶液褪色;
(3)二氧化硫具有还原性能被铁离子氧化为硫酸根离子和亚铁离子,则将SO2气体通入FeCl3溶液中的离子反应为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,
故答案为:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
点评 本题考查了二氧化硫的实验室制备及性质检验,明确制备原理及二氧化硫性质是解题关键,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
9.已知氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列有关叙述中不正确的是( )
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体生成.
①NH4H是离子化合物,含有离子键和共价键 ②NH4H溶于水所形成的溶液显酸性
③NH4H与水反应时,NH4H是氧化剂 ④NH4H固体投入少量的水中,有两种气体生成.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
4.下列关于糖类、油脂、蛋白质的说法正确的是( )
| A. | 蔗糖在人体内水解产物只有葡萄糖 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 淀粉和纤维素水解最终产物都是葡萄糖 | |
| D. | 鉴别部分蛋白质可利用浓硫酸与蛋白质的颜色反应 |
11.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3).

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
表2原料价格表
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)在步骤②中加入的试剂X,最佳的选择是漂液NaClO,其反应的离子方程式是2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(2)在步骤③中如要控制pH=9.8,其目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去;在步骤④中加入的试剂Z应该是Na2CO3;
(3)在步骤⑤中发生的化学方程式是MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
8.颠茄酸酯(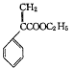 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 1mol颠茄酸酯最多与4molBr2发生加成反应 | |
| C. | 能与NaHCO3溶液反应 | |
| D. | 能与NaOH溶液反应 |
9.将0.01mol NaOH和0.01mol Na2CO3混合并配成溶液,滴加amL、0.1mol•L-1稀盐酸,下列说法不正确的是( )
| A. | 当a≤100时,发生的离子反应为:OH-+H+=H2O | |
| B. | 当a≥300时,发生的离子反应为:OH-+3H++CO32-=2H2O+CO2↑ | |
| C. | 当100<a<200时,反应后的溶液中CO32-与HCO3-的物质的量之比为(a×10-4-0.01):(0.02-a×10-4) | |
| D. | 当a=200时,发生的离子反应为:OH-+2H++CO32-=H2O+HCO3- |
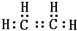 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH
 .
.