题目内容
10.常温下,物质的量浓度均为0.1mol•L-1的下列溶液:①Na2CO3溶液 ②NaOH溶液 ③NaHSO4溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由小到大的排列顺序是( )| A. | ③<④<⑤<①<② | B. | ④<③<⑤<①<② | C. | ④<③<①<⑤<② | D. | ①<④<③<⑤<② |
分析 ①②为碱性,等浓度强碱溶液的pH大,③④为酸性,等浓度时③中酸性强,则③中pH最小,⑤为中性,以此来解答.
解答 解:①②为碱性,①中水解显碱性,等浓度强碱溶液的pH大,则pH为②>①;
③④为酸性,③电离显酸性,④水解显酸性,等浓度时③中酸性强,则③中pH最小,pH为③<④,
⑤为中性,
则溶液的pH由小到大的排列顺序是③<④<⑤<①<②,
故选A.
点评 本题考查pH的比较,为高频考点,把握盐类水解、电解质的电离、pH与酸碱性的关系为解答的关键,侧重分析与应用能力的考查,注意强酸酸式盐电离显酸性,题目难度不大.

练习册系列答案
相关题目
17.一定条件下,一种反应物过量,另一种反应物可以完全反应的是( )
| A. | 过量的氧气与二氧化硫 | B. | 过量的氢氧化钠与二氧化硅 | ||
| C. | 过量的二氧化锰与浓盐酸 | D. | 过量的铜与浓硫酸 |
14.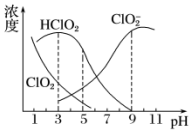 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka约为10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | ClO2可用于自来水的消毒 |
5.把NaHCO3和Na2CO3•10H2O混合物6.56g溶于水制成100mL溶液,其中c(Na+)=0.5mol•L-1.如果把6.56g这种混合物加热至恒重会失重多少克( )
| A. | 2.65g | B. | 3.56g | C. | 3.91g | D. | 4.6g |
2.下列化学用语正确的是( )
| A. | HF的电子式:H+[:tr | |
| B. | Cl-离子的结构示意图: | |
| C. | 乙酸的结构简式:C2H3O2 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
19.近来网络上流传“小苏打能饿死癌细胞”.下列关于小苏打的叙述准确的是( )
| A. | 化学式为Na2CO3 | B. | 受热不分解 | C. | 属于盐 | D. | 与盐酸不反应 |
20.下列反应的产物一定是纯净物的是( )
| A. | 丙烯加聚 | B. | 丙烯与Br2加成 | ||
| C. | 丙烯与水加成 | D. | 丙烷与Br2光照取代 |
