题目内容
欲测定某铝铜合金的组成,进行了如下实验:称取粉末状样品1.0克,加入某浓度的盐酸10mL,充分反应后,收集到标准状况下气体224mL;然后,再往样品中加入同浓度的盐酸10mL,充分反应后又收集到标准状况下气体112mL.
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度.
(2)样品中铝的质量分数.
试求:(写出具体计算过程)
(1)所取盐酸的物质的量浓度.
(2)样品中铝的质量分数.
考点:有关混合物反应的计算,物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:(1)由题意可知,第一次加入的盐酸完全反应,根据n=
计算生成氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),再根据c=
计算;
(2)第二次加入10mL盐酸,合金中的铝完全反应,盐酸过量,总共生成氢气体积为224mL+112mL=336mL,根据n=
计算生成氢气的物质的量,根据电子转移守恒计算n(Al),再根据m=nM计算m(Al),进而计算Al的质量分数.
| V |
| Vm |
| n |
| V |
(2)第二次加入10mL盐酸,合金中的铝完全反应,盐酸过量,总共生成氢气体积为224mL+112mL=336mL,根据n=
| V |
| Vm |
解答:
解:①第一次加入的盐酸完全反应,生成氢气为
=0.01mol,根据氢元素守恒可知n(HCl)=2n(H2)=0.01mol×2=0.02mol,故c(HCl)=
=2mol/L,
答:所取盐酸的物质的量浓度为2mol/L.
②第二次加入10mL盐酸,合金中的铝完全反应,盐酸过量,总共生成氢气体积为224mL+112mL=336mL,其物质的量为
=0.015mol,根据电子转移守恒,3n(Al)=0.015mol×2,故n(Al)=0.01mol,m(Al)=0.01mol×27g/mol=0.27g,故该合金中Al的质量分数=
×100%=27%,
答:该合金中Al的质量分数为27%.
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 0.01L |
答:所取盐酸的物质的量浓度为2mol/L.
②第二次加入10mL盐酸,合金中的铝完全反应,盐酸过量,总共生成氢气体积为224mL+112mL=336mL,其物质的量为
| 0.336L |
| 22.4L/mol |
| 2.7g |
| 1.0g |
答:该合金中Al的质量分数为27%.
点评:本题考查混合物计算,难度不大,判断Al与盐酸反应的过量情况是关键,利用守恒思想进行解答,简化计算过程,也可以利用方程式计算.

练习册系列答案
相关题目
将 N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)=3mol/(L?min);乙 v( N2 )=2mol/(L?min);丙 v(NH3)=1mol/(L?min).在这段时间内三个容器中合成氨的反应速率( )
| A、甲>乙>丙 |
| B、甲=乙=丙 |
| C、乙>甲>丙 |
| D、甲>丙>乙 |
用A、B两根石墨棒作电极电解AgNO3溶液,通电tmin时,在B极上共产生11.2mL(标准状况下)气体.然后将电极A、B与电反接,用相同的电流再电解0.5tmin,两极上均无气体产生,最终溶液的体积为200mL,则该溶液的pH接近于( )
| A、2 | B、2.7 | C、3 | D、4 |
12.8g Cu投入100mL 10mol/L的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标况下气体4.48L.将盛有此气体的容器倒扣在水槽中,通入标况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
| A、2.24L |
| B、3.36L |
| C、1.68L |
| D、5.04L |
自来水一般用氯气消毒,因此自来水中含有氯离子.下面是某同学设计的检验自来水中氯离子的方法,其中可靠的是( )
| A、尝一尝自来水有没有咸味 |
| B、先加稀HCl,后加入AgNO3溶液,看有无白色沉淀 |
| C、加入AgNO3溶液,再加入足量稀HNO3,看有无白色沉淀 |
| D、直接加入AgNO3溶液,看有无白色沉淀 |
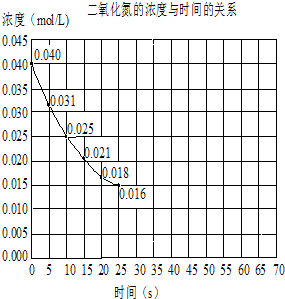 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.