题目内容
1.有A、B、C、D、E五种短周期主族元素,原序数由A到E逐渐增大.①A元素最外层电子数是次外层电子数的2倍.
②B的阴离子和C的阳离子与氖原子的电子层结构相同.
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移.
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体.
⑤D的气态氢化物有臭鸡蛋气味.请写出:
(1)A元素的最高价氧化物的结构式O=C=O
(2)C元素在周期表中的位置第三周期第IA族
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有离子键、非极性键(或共价键)
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl
(5)元素D与元素E相比,非金属性较弱的是S(用元素符号表示),下列表述中能证明这一事实的是d(填选项序号).
a.常温下D的单质和E的单质状态不同
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质.
(6)C分别与B、E形成的简单化合物中,熔沸点较大的是Na2O.
分析 有A、B、C、D、E五种短周期主族元素,原序数由A到E逐渐增大.
①A元素最外层电子数是次外层电子数的2倍,则A为2个电子层、最外层电子数为4,可知A为C元素;
②B的阴离子和C的阳离子与氖原子的电子层结构相同,均为10电子;
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移,可知B为双原子分子,且元素的化合价由0降低为-2价,则B为O元素;
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,淡黄色固体为过氧化钠,C为Na元素;
⑤D的气态氢化物有臭鸡蛋气味,硫化物为H2S,可知D为D,结合E为短周期元素,且原子序数大于S,则E为Cl,以此来解答.
解答 解:由上述分析可知,A为C,B为O,C为Na,D为S,E为Cl,
(1)A元素的最高价氧化物为二氧化碳,其结构式为O=C=O,故答案为:O=C=O;
(2)C为Na,在周期表中的位置为第三周期第IA族,故答案为:第三周期第IA族;
(3)B单质与C单质在点燃时反应的生成物为过氧化钠,所含化学键类型有离子键、非极性键(或共价键),故答案为:离子键、非极性键(或共价键);
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)同周期从左向右非金属性增强,则元素D与元素E相比,非金属性较弱的是S,
a.常温下D的单质和E的单质状态不同,与非金属性无关,故不选;
b.E的氢化物水溶液酸性比D的氢化物水溶液酸性强,不能利用氢化物的酸性比较非金属性,故不选;
c.一定条件下D和E的单质都能与钠反应,D、E均得到电子,不能比较非金属性,故不选;
d.D的最高价含氧酸酸性弱于E的最高价含氧酸,可知非金属性E>D,故选;
e.D的单质不能与E的氢化物反应生成E单质,说法错误,故不选;
故答案为:S;d;
(6)C分别与B、E形成的简单化合物分别为Na2O、NaCl,均为离子晶体,阴离子的电荷越大、离子半径越小,晶格能越大,则熔沸点较大的是Na2O,
故答案为:Na2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识的应用,题目难度不大.

| A. | 32种 | B. | 24种 | C. | 16种 | D. | 8种 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)反应是吸热反应.能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为830℃
| 元素编号 | 原子结构或元素性质 |
| X | 单质在常温下为黄绿色气体,水溶液具有漂白性 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 常见的金属,既能与强酸反应又能与强碱反应 |
| M | 最高正价与最低负价代数和为4 |
| N | N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄 有三种氧化物,其中一种氧化物具有磁性 |
 ;
;(2)写出Z单质与Y的最高价氧化物对应的水化物反应的离子方程式2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑(或2Al+2OH-+2H2O=2AlO2-+3H2↑);
(3)X单质的水溶液与M的常见氧化物可用作漂白剂,写出两者之间反应的化学方程式Cl2+SO2+2H2O=H2SO4+2HCl;
(4)请写出判断Y、Z金属性强弱的一个事实氢氧化钠的碱性强于氢氧化铝碱性.
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含M的最高价氧化物的水化物溶液直至过量的过程中发生的现象是:先出现沉淀,然后沉淀溶解.
(6)已知:298K时固体Z在氧气中燃烧生成1mol Z2O3固体时,放出热量1676.2kJ;固体N在氧气中燃烧生成1mol N3O4固体时,放出热量1118.4kJ.请写出298K时,由Z单质与N3O4反应的热化学方程式:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-3349.6KJ/mol.

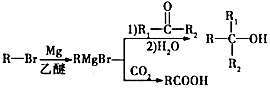
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
. (写结构简式).
(写结构简式).
 .
. .
.