题目内容
2.下列叙述正确的是( )| A. | 氨水能导电,所以氨水是电解质 | |
| B. | 氯化氢溶于水后能导电,但液态氯化氢不能导电 | |
| C. | 溶于水后能电离出H+的化合物都是酸 | |
| D. | 导电性强的物质一定是强电解质 |
分析 A、电解质必须为化合物;
B、氯化氢溶于水中有自由移动的离子,但是液态氯化氢中只有分子;
C、酸是溶于水后电离出的阳离子全部是H+的化合物;
D、溶液的导电性与离子浓度有关,还与离子所带电荷多少有关,与是否是强电解质无关.
解答 解:A、氨水是氨气的水溶液为混合物,不是电解质,故A错误;
B、氯化氢溶于水形成的盐酸中有自由移动的离子而能导电,但是液态氯化氢中只有分子不能导电,故B正确;
C、酸是溶于水后电离出的阳离子全部是H+的化合物,溶于水后能够电离出H+的化合物不一定是酸,如硫酸氢钠属于盐,故C错误;
D、溶液的导电性与离子浓度有关,还与离子所带电荷多少有关,与是否是强电解质无关,所以浓度很小的强电解质导电性弱,而浓度很大的弱电解质导电性反而强,故D错误;
故选B.
点评 本题考查了电解质、非电解质的导电性分析和判断以及酸的判断,主要是概念实质理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
13.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是( )
| A. | 木已成舟 | B. | 百炼成钢 | C. | 铁杵成针 | D. | 滴水成冰 |
10.离子键是( )
| A. | 原子间的强烈的静电作用 | B. | 阴、阳离子间的强烈的吸引作用 | ||
| C. | 阴、阳离子间的强烈的静电作用 | D. | 阴、阳离子间的强烈的排斥作用 |
7. 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( ) | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | CaCl2溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是( )
| A. | HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强 | |
| B. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| C. | 在O2、CO2和SiO2中,都存在共价键,它们均由分子构成 | |
| D. | KOH和MgCl2都是离子晶体,均在共价键和离子键 |
 ,空间构型三角锥形
,空间构型三角锥形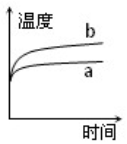
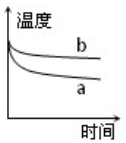
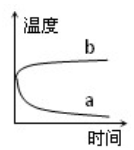
 X、Y、Z、W有如图所示的转化关系:
X、Y、Z、W有如图所示的转化关系: