题目内容
制备氢氧化铝
(1)往氯化铝溶液中加过量氨水:离子方程式: ;
(2)往偏铝酸钠溶液中通过量二氧化碳:离子方程式: .
(1)往氯化铝溶液中加过量氨水:离子方程式:
(2)往偏铝酸钠溶液中通过量二氧化碳:离子方程式:
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:(1)氯化铝可以和一水合氨发生反应生成的氢氧化铝不溶于弱碱中,据离子方程式的书写方法来书写;
(2)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,根据离子方程式的书写方法来书写.
(2)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,根据离子方程式的书写方法来书写.
解答:
解:(1)氯化铝可以和一水合氨发生反应生成氢氧化铝和氯化铵,生成的Al(OH)3不溶于过量的氨水,所以离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
(2)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
点评:书写离子方程式应先写出化学方程式,再根据电离的实际将其改写为离子方程式.关键看“分子”、“离子”书写是否得当.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A、C3H8、C4H6O2 |
| B、C2H6、C2H6O |
| C、C2H2、C6H6 |
| D、C3H6O、C3H8O2 |
能实现Al3++3AlO2-+6H2O=4Al(OH)3↓过程的是( )
| A、向铝盐溶液中不断滴加氢氧化钠溶液 |
| B、向偏铝酸盐溶液中不断加入盐酸 |
| C、向偏铝酸钠溶液中不断通入二氧化碳气体 |
| D、向氢氧化钠溶液中不断滴加铝盐溶液 |
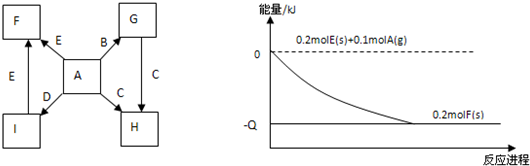
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径:Q>T>R |
| B、最高价氧化物对应水化物的酸性:Q<W |
| C、气态氢化物的稳定性:R>Q |
| D、Q的氧化物只能与碱反应 |
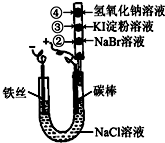 某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )
某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )| A、碳棒的电极反应式为2Cl--2e-=Cl2↑ | ||||
| B、②处、③处白色棉球分别变为橙黄色、蓝色 | ||||
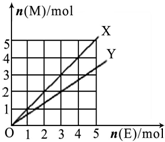
C、如图X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式Mg+Cl2
 | ||||
| D、在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入3.65gHCl气体 |
最简单的烃,下列关于甲烷的叙述中不正确的是( )
| A、甲烷是烃类物质中相对分子质量最小的物质 |
| B、1molCH4在光照条件下最多能与4molCl2反应 |
| C、甲烷的二氯代物只有一种可以证明甲烷为正四面体结构 |
| D、甲烷与空气的体积比为1:2时,混合气点燃爆炸最剧烈 |
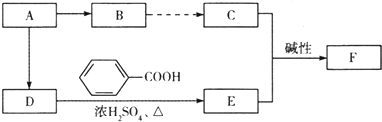
 ),注:部分物质省略.
),注:部分物质省略.