题目内容
能正确表示下列反应的离子方程式是( )
A、氯化钠与浓硫酸混合加热:H2SO4+2Cl-
| ||||
| B、用过量氨水吸收工业尾气中的SO2:NH3?H2O+SO2═2NH4++SO32-+H2O | ||||
| C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氯化钠与浓硫酸反应生成氯化氢气体,不会生成氯气;
B.氨水过量,反应生成亚硫酸铵,其中一水合氨需要保留分子式;
C.磁性氧化铁为四氧化三铁,离子方程式中四氧化三铁需要保留化学式;
D.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,恰好生成偏铝酸根离子.
B.氨水过量,反应生成亚硫酸铵,其中一水合氨需要保留分子式;
C.磁性氧化铁为四氧化三铁,离子方程式中四氧化三铁需要保留化学式;
D.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,恰好生成偏铝酸根离子.
解答:
解:A.氯化钠溶液和浓硫酸混合加热生成的是氯化氢气体,反应的化学方程式为2NaCl+H2SO4(浓)
Na2SO4+2HCl↑,离子方程式为H2SO4(浓)+2Cl-
2HCl↑+SO42-,故A错误;
B.用过量氨水吸收工业尾气中的SO2,反应生成亚硫酸铵和水,反应的离子方程式为NH3?H2O+SO2═2NH4++SO32-+H2O,故B正确;
C.磁性氧化铁溶于稀硝酸,磁性氧化铁为四氧化三铁,正确的离子方程式为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故C错误;
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,铝离子完全转化成偏铝酸根离子,正确的离子方程式为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选B.
| ||
| ||
B.用过量氨水吸收工业尾气中的SO2,反应生成亚硫酸铵和水,反应的离子方程式为NH3?H2O+SO2═2NH4++SO32-+H2O,故B正确;
C.磁性氧化铁溶于稀硝酸,磁性氧化铁为四氧化三铁,正确的离子方程式为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故C错误;
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,铝离子完全转化成偏铝酸根离子,正确的离子方程式为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、化学变化过程是原子的重新组合过程 |
| B、化学反应可分为吸热反应和放热反应 |
| C、化学反应中能量变化的多少与其反应物的质量有关 |
| D、化学变化中的能量变化都是以热能形式表现出来的 |
下面4组物质中,能发生反应且既属于离子反应又属于氧化还原反应的是( )
| A、硫酸钠溶液与氯化钡溶液 |
| B、铝片与硝酸汞溶液 |
| C、稀硫酸与铜片 |
| D、硝酸钠溶液与氯化钾溶液 |
下列有关油脂的说法错误的是( )
| A、油脂的主要成分是高级脂肪酸的甘油酯,属于酯类 |
| B、天然油脂大多数是由混甘油酯构成的混合物 |
| C、油脂的水解反应叫做皂化反应 |
| D、油脂里饱和烃基的相对含量越大,熔点越高 |
下列各化合物中,可以发生酯化、还原、加成、消去四种反应的是( )
A、 |
B、 |
C、 |
D、 |
下列关于SiO2的说法正确的是( )
| A、用来制造光导纤维 |
| B、能与盐酸发生反应 |
| C、能跟水反应生成硅酸 |
| D、用作半导体材料 |
下列关于中性溶液的说法正确的是( )
| A、中性溶液就是PH=7的溶液 |
| B、中性溶液是指c(H+)=c(OH-)的溶液 |
| C、酸与碱恰好完全中和所得的溶液是中性溶液 |
| D、不能使酸碱指示剂显色的溶液是中性溶液 |
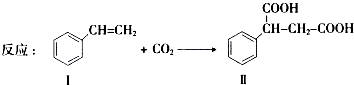
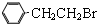 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为