题目内容
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是FeSO4、Na2O2,每生成l mol Na2FeO4转移5mol电子.
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
②每生成1mol FeO42-转移3mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为0.15mol.
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题该温度下,K2FeO4的溶解度比Na2FeO4的溶解度更小.
分析 (1)所含元素化合价升高的反应物是还原剂,反应中化合价升高的元素有Fe、O元素,计算生成氧气物质的量,再根据Fe元素、O元素化合价变化计算转移电子;
(2)①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5;
②根据Fe元素化合价变化计算转移电子,还原产物为Cl-,根据Cl元素化合价变化计算生成Cl-的物质的量;
③由溶解度大的转化生成溶解度更小的物质.
解答 解:(1)所含元素化合价升高的反应物是还原剂,反应中化合价升高的元素有Fe、O元素,故还原剂为FeSO4、Na2O2,由方程式可知,每生成l mol Na2FeO4同时生成0.5mol氧气,则转移电子为1mol×(6-2)=0.5mol×2×[0-(-1)]=5mol,
故答案为:FeSO4、Na2O2;5;
(2)①湿法制备高铁酸钾(K2FeO4),则FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②反应中Fe元素化合价变化由+3价升高为+6,故每生成1mol FeO42-转移电子,1mol×(6-3)=3mol,还原产物为Cl-,若反应过程中转移了0.3mol电子,则还原产物的物质的量为$\frac{0.3mol}{1-(-1)}$=0.15mol,
故答案为:3;0.15;
③该温度下,K2FeO4的溶解度比Na2FeO4的溶解度更小,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),
故答案为:该温度下,K2FeO4的溶解度比Na2FeO4的溶解度更小.
点评 本题考查氧化还原反应计算与配平、物质的分离提纯等,(1)为易错点,注意根据元素化合价理解.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基丁烷 | ||
| C. | 2-乙基丁烷 | D. | 2,3,3-三甲基丁烷 |
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(2)除去反应混合物中的不溶物;
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4;
下列说法不正确的是( )
| A. | 步骤(1)中每析出12.8g S沉淀共转移0.4mol电子 | |
| B. | 步骤(1)中ZnS的还原性大于MnSO4的还原性 | |
| C. | 电解时MnO2在阳极处产生 | |
| D. | 硫酸在生产中可循环使用 |
①加入稀硫酸有气泡产生 ②加入稀硫酸后,没有气泡生成 ③加入稀硫酸后,溶液中有红色不溶物出现 ④插入溶液中铁片表面有红色物质析出.
| A. | 只有②③ | B. | 只有③④ | C. | 只有④ | D. | ①②③④ |

(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O
 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ. | t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K=$\frac{1600}{9}$.
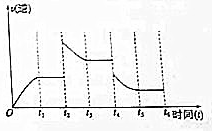
(3)若该反应的逆反应速率与时间的关系如图所示.则:
①t2~t3时平衡向逆(填“正”或“逆”)反应方向移动.
②t4时被改变的外界条件是B(选择一个正确选项)
A升温 B降温 C.降压 D.移去部分反应物 E加入负催化剂.
 或
或 .
.