题目内容
18.设 NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 10mL20mol/L 浓硫酸与足量锌反应,转移电子数为 0.2NA | |
| B. | 0.1mol24Mg18O 晶体中所含中子总数为 2.0NA | |
| C. | 在标准状况下,2.8gN2和 2.24LCO 所含电子数均为 1.4NA | |
| D. | 1L1mol/L 的 NaClO 溶液中含有 ClO-的数目为 NA |
分析 A、12.5mL 16mol/L的浓硫酸中含有0.2mol硫酸,与锌反应时先生成二氧化硫,等硫酸变稀时后生成氢气.
B、中子数=质量数-质子数,1mol24Mg18O中含有的中子物质的量为(24-12)+(18-8)=22mol,根据N=nNA计算中子数目.
C、氮气分子和一氧化碳分子是等电子体,且分子量相同,所以可以把混合物当作一种物质进行计算,根据气体的物质的量和分子的构成计算电子数;
D、ClO-是弱酸根,在溶液中会水解.
解答 解:10mL 20mol/L的浓硫酸中含有0.2mol硫酸,与锌反应时先是硫元素被还原生成二氧化硫:Zn+SO42-+4H+=Zn2++SO2↑+2H2O,此时当反应掉4mol氢离子时,转移2mol电子;如果氢离子有剩余,锌和氢离子再反应:Zn+2H+=Zn2++H2↑,此反应中2mol氢离子转移2mol电子,而溶液中共0.4mol氢离子,故转移的电子数介于0.2NA和0.4NA之间,故A错误.
B、1mol24Mg18O中含有的中子物质的量为(24-12)+(18-8)=22mol,0.1 mol24Mg18O晶体中所含中子总数为0.1×22mol×NAmol-1=2.2NA,故B错误;
C、一个氮气分子或一氧化碳分子中都含有14的电子,氮气和一氧化碳的摩尔质量相等,所以可把两种物质当成一种物质进行计算,2.8 g N2和2.8 g CO的物质的量都是0.1mol,含有的电子数都是1.4 NA,故C正确;
D、ClO-是弱酸根,在溶液中会水解,故溶液中ClO-的个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.不属于NO3-的等电子体的是( )
| A. | NO2 | B. | BF3 | C. | SO3 | D. | NF32+ |
3.化学与生产、生活密切相关.下列说法错误的是( )
| A. | “硅胶”常用作袋装食品的干燥剂 | |
| B. | 氢氧化铝具有弱碱性,常用作胃酸中和剂 | |
| C. | 碳纤维,是一种新型无机非金属材料 | |
| D. | 工业上以氯气和澄清石灰水为原料制造漂白粉 |
10.由有机物CH≡CH、HCN、CH3COOH合成高分子[CH2-CH(CN)CH2CH(OOCCH3)]n,则反应类别是( )
| A. | 加成、酯化、缩聚 | B. | 加成、加成、加聚 | C. | 加成、消去、加聚 | D. | 加成、取代、缩聚 |
7.下列事故处理方法不正确的是( )
| A. | 手上滴了浓硫酸立即用大量水冲洗 | |
| B. | 皮肤上沾了苯酚马上用浓氢氧化钠溶液洗涤 | |
| C. | 金属钠着火,迅速用沙土灭火 | |
| D. | 水银温度计不慎打破,迅速将水银收集水封,收集不起来的用硫粉盖上 |
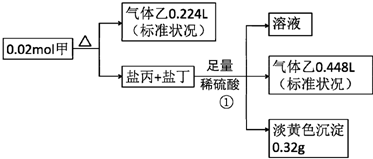
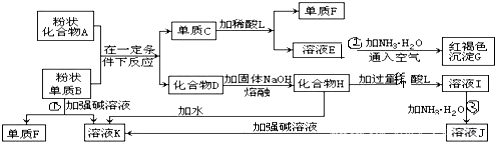
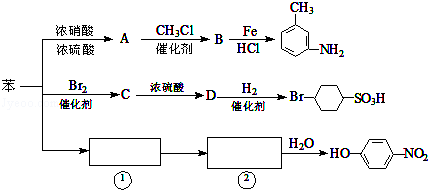
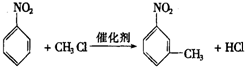 .
.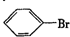 ,②
,②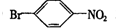 .
.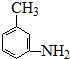 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.