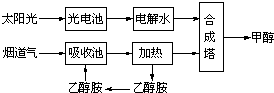
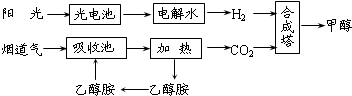
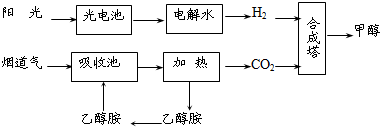
题目内容
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)下列叙述正确的是
a.使用Cu-Zn-Fe催化剂可大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入大量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率.

(1)该合成路线对于环境保护的价值在于
有利于防止温室效应
有利于防止温室效应
.(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-
HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-
.(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
CO2(g)+3H2(g)→CH3OH(l)+H2O(l)△H=-131.9kJ/mol
CO2(g)+3H2(g)→CH3OH(l)+H2O(l)△H=-131.9kJ/mol
.(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)下列叙述正确的是
acd
acd
.a.使用Cu-Zn-Fe催化剂可大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入大量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率.
分析:(1)根据二氧化碳产生的危害进行分析;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式;
(4)根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,并注意吸热反应与反应的条件无关.
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式;
(4)根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,并注意吸热反应与反应的条件无关.
解答:解:(1)二氧化碳会产生温室效应,而本题中的反应恰好消耗了二氧化碳,有利于防止温室效应;
故答案为:减少烟道气中二氧化碳排放到空气中造成温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
故答案为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
×②-①×
;所以△H=×
(-571.6KJ/mol)-(-1451kJ/mol)×
=-131.9KJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9KJ/mol;
(4)a、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故a对;
b、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故b错;
c、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故c对;
d、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故d对;
故选acd;
故答案为:acd;
故答案为:减少烟道气中二氧化碳排放到空气中造成温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
故答案为:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9KJ/mol;
(4)a、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故a对;
b、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故b错;
c、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故c对;
d、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故d对;
故选acd;
故答案为:acd;
点评:本题考查热化学方程式书写,燃烧热概念分析应用,流程分析,化学反应速率和化学平衡知识,易错点为利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的信息为温度条件则无法判断,升高温度化学平衡向吸热的方向移动,而吸热反应取决于反应物与生成物总能量的相对大小.题目难度中等.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
(14分)Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g)
+ 3H2O(g)
CH3OCH3(g)
+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
|
投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
(4)该反应的焓变△H 0,熵变△S___0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。