��Ŀ����
����������Ƥ�����Ƶ���Ҫ��ѧ�Լ���������ˮâ����Na2SO4����̿���ڸ����·�Ӧ���Ƶã���Ӧʽ���£�
�� Na2SO4 + 4C ���� �� Na2S + 4CO
�� Na2SO4 + 4 CO���� �� Na2S + 4CO2
(1)��Ҫ��ȡNa2S 7.8�ˣ���Ҫ��ˮâ����Na2SO4�� g��
(2)���ڷ�Ӧ�����ɵ�Na2S���ʵ���Ϊ1 mol�������ĵ�̼���ʵ����ʵ�����Χn�ķ�Χ�� < n < ��
(3)����������Ӧ�����ĵ�̼����Ϊ1mol������Na2S�����ʵ���Ϊ y mol�����ɵ�CO��CO2�����ʵ���֮��Ϊx����y��x�Ĺ�ϵʽΪy= ��
(4)Na2S�����ڿ����У��Ỻ��������Na2SO3��Na2SO4���ֳ�ȡ�Ѿ�����������������39.2 g����ˮ�У������������ᣬ��ַ�Ӧ���˵ó���9.6g���ų�H2S����1.12L(��״��)����39.2g������������������Na2S�����ʵ���Ϊ mol��Na2SO3�����ʵ���Ϊ mol��Na2SO4�����ʵ���Ϊ mol��
(1) 14.2 ��2�֣� (2) 2 ~4 ��2�֣�(3) y = ��3�֣� (4)0.25��010 ��0.05 ��3�֣�
����:
��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
 4C
4C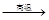 Na2S
Na2S ���� ��������
���� �������� Na2S+4CO�� �� Na2SO4+4CO
Na2S+4CO�� �� Na2SO4+4CO