题目内容
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C
| 高温 |
| 高温 |
(1)现要制取Na2S 11.70g,若生成过程中无水芒硝的利用率为90%,则理论上需要无水芒硝
(2)若在反应过程中生成的Na2S 物质的量为3mol,则消耗的碳单质的物质的量 n的范围是
(3)若在上述反应中消耗的碳单质为1mol,生成 Na2S的物质的量为 ymol,生成的 CO 和 CO2的物质的量之比为 x,则x 与 y的关系为 y=
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO4 及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g 溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L (标准状况).请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程).
分析:(1)根据n=
计算11.70gNa2S的物质的量,根据硫元素守恒计算需要无水芒硝的物质的量,再根据m=nM计算无水芒硝的质量;
(2)若生成的气体为CO,消耗的碳的物质的量最多,若生成的气体为CO2,消耗的碳的物质的量最少;
若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒计算需要碳的物质的量;
若生成等物质的量CO和CO2,根据电子转移守恒计算CO和CO2的物质的量,再根据碳原子守恒计算碳的物质的量;
(3)计算CO 和 CO2各自的物质的量,再根据电子转移守恒列等式,确定x 与 y的关系;
(4)Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O,故19.2g为硫的质量,放出H2S气体2.24L,还发生反应2HCl+Na2S=2NaCl+H2S↑,根据n=
计算S的物质的量,进而计算生成S的反应中参加反应的Na2S、Na2SO3各自的物质的量,根据n=
计算H2S的物质的量,进而计算与盐酸反应生成H2S气体需要Na2SO3的物质的量,再根据m=nM计算样品中Na2S、Na2SO3各自的质量,继而计算Na2SO4的质量,根据n=
计算Na2SO4的物质的量.
| m |
| M |
(2)若生成的气体为CO,消耗的碳的物质的量最多,若生成的气体为CO2,消耗的碳的物质的量最少;
若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒计算需要碳的物质的量;
若生成等物质的量CO和CO2,根据电子转移守恒计算CO和CO2的物质的量,再根据碳原子守恒计算碳的物质的量;
(3)计算CO 和 CO2各自的物质的量,再根据电子转移守恒列等式,确定x 与 y的关系;
(4)Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O,故19.2g为硫的质量,放出H2S气体2.24L,还发生反应2HCl+Na2S=2NaCl+H2S↑,根据n=
| m |
| M |
| V |
| Vm |
| m |
| M |
解答:解:(1)11.70gNa2S的物质的量为
=
mol,根据硫元素守恒可知,需要无水芒硝的物质的量为
,故需要芒硝的质量为
×142g/mol=23.67g,
故答案为:23.67;
(2)若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C
Na2S+4CO↑可知,生成3molNa2S需要碳的物质的量为3mol×4=12mol,若生成的气体为CO2,消耗的碳的物质的量最少,根据电子转移守恒可知,生成3molNa2S需要碳的物质的量为
=6mol,故消耗的碳单质的物质的量 n的范围是6mol≤n≤12mol;
若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒可知,生成3molNa2S需要碳的物质的量为
=6mol;
若生成等物质的量CO和CO2,令各自物质的量为ymol,根据电子注意守恒,则2y+4y=3×[6-(-2)],解得y=4,根据碳原子守恒可知,需要碳的物质的量为4mol+4mol=8mol,
故答案为:6;12;6;8;
(3)消耗的碳单质为1mol,根据碳原子守恒,生成的 CO 和 CO2的总物质的量为1mol,生成的CO和CO2的物质的量之比为x,令CO2的物质的量为amol,则a+ax=1,故a=
,则CO的物质的量为
,反应生成 Na2S的物质的量为ymol,根据电子转移守恒有:y×[6-(-2)]=
×4+
×2,整理得y=
,
故答案为:
;
(4)19.2g为硫的物质的量为
=0.6mol,由方程式:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O可知,参加该反应
的Na2S为0.6mol×
=0.4mol,Na2SO3的物质的量为0.6mol×
=0.2mol,
2.24LH2S气体的物质的量为
=0.1mol,根据反应2HCl+Na2S=2NaCl+H2S↑可知,参加该反应的Na2S的物质的量为0.1mol,故样品中Na2SO4的质量为78.40g-0.2mol×126g/mol-(0.4mol+0.1mol)×78g/mol=14.2g,故Na2SO4的物质的量为
=0.1mol,
故78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol,
答:78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol.
| 11.7g |
| 78g/mol |
| 11.7 |
| 78 |
| ||
| 90% |
| ||
| 90% |
故答案为:23.67;
(2)若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C
| 高温 |
| 3mol×[6-(-2)] |
| 4 |
若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒可知,生成3molNa2S需要碳的物质的量为
| 3mol×[6-(-2)] |
| 4 |
若生成等物质的量CO和CO2,令各自物质的量为ymol,根据电子注意守恒,则2y+4y=3×[6-(-2)],解得y=4,根据碳原子守恒可知,需要碳的物质的量为4mol+4mol=8mol,
故答案为:6;12;6;8;
(3)消耗的碳单质为1mol,根据碳原子守恒,生成的 CO 和 CO2的总物质的量为1mol,生成的CO和CO2的物质的量之比为x,令CO2的物质的量为amol,则a+ax=1,故a=
| 1 |
| 1+x |
| x |
| 1+x |
| 1 |
| 1+x |
| x |
| 1+x |
| x+2 |
| 4+4x |
故答案为:
| x+2 |
| 4+4x |
(4)19.2g为硫的物质的量为
| 19.2g |
| 32g/mol |
的Na2S为0.6mol×
| 2 |
| 3 |
| 1 |
| 3 |
2.24LH2S气体的物质的量为
| 2.24L |
| 22.4L/mol |
| 14.2g |
| 142g/mol |
故78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol,
答:78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol.
点评:本题考查混合物的有关计算,注意利用极限法与守恒法进行的计算,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
 4C
4C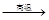 Na2S
Na2S ;
; Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO