题目内容
8.在实验或生活中为了控制反应速率,下列做法不正确的是( )| A. | 用氯酸钾制取氧气时可加入少量的高锰酸钾以加快反应速率 | |
| B. | 为加快制取氢气的速率用锌粉代替锌粒 | |
| C. | 为降低HNO3与Cu反应制备NO2的速率可以采用稀硝酸代替浓硝酸 | |
| D. | 为了延长食品的保质期在食品包装袋中加入硅胶、硫酸亚铁 |
分析 A.高锰酸钾分解生成的二氧化锰可起到催化剂的作用;
B.锌粉的表面积较大;
C.稀硝酸与浓硝酸的性质不同;
D.硅胶具有干燥的功能,硫酸盐铁具有还原性.
解答 解:A.高锰酸钾分解生成的二氧化锰可起到催化剂的作用,可加快反应速率,故A正确;
B.锌粉的表面积较大,可加快反应速率,故B正确;
C.稀硝酸与浓硝酸的性质不同,稀硝酸生成NO,而浓硝酸生成二氧化氮,故C错误;
D.硅胶具有干燥的功能,硫酸盐铁具有还原性,可延长食品的保质期,故D正确.
故选C.
点评 本题考查化学反应速率的影响,为高频考点,侧重考查学生的分析能力,有利于培养学生的良好的科学素养,注意把握影响化学反应速率的因素,难度不大.

练习册系列答案
相关题目
18.下列有关物质的检验或区分方法中正确的是( )
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ | |
| C. | 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+ | |
| D. | 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有碳酸盐 |
19.将CH3COOH和H18OC2H5在一定条件下发生酯化反应,已知酯化反应是可逆的,反应达到平衡后下列说法正确的是( )
| A. | 18O存在于所有物质中 | B. | 有的乙醇分子可能不含18O | ||
| C. | 所得酯的相对分子质量为88 | D. | 18O仅存在于乙醇和乙酸乙酯里 |
16.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组成( )
| A. | CH3COO- | B. | NH4+ | C. | Fe2+ | D. | Ba2+ |
3.下列属于强电解质的是( )
| A. | NaCl溶液 | B. | HClO | C. | NaOH | D. | 蔗糖 |
13.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
20. 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
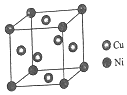
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
17.4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.回答下列问题:
(1)元素N在周期表中的位置是二周期VA族.
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
| M | N | ||
| X | Y |
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
18.常温下,下列各组离子或分子在指定溶液中可能大量共存的是( )
| A. | pH=7的溶液:Fe3+、NH4+、Cl-、NO3- | |
| B. | 水电离出的c(H+)=$\sqrt{{K}_{w}}$的溶液中:Na+、SO42-、CO32-、K+ | |
| C. | 由水电离出的c(OH-)=1.0×10-2 mol•L-1的溶液:Cl-、CH3COO-、K+、[Al(OH)4]- | |
| D. | $\frac{[O{H}^{-}]}{[{H}^{+}]}$=1012的溶液中,NH4+、Al3+、NO3-、Cl- |