题目内容
【题目】铁是一种过渡元素,金属铁是最常用的金属材料。请回答下列有关问题:
(1)工业上常利用CO还原铁的氧化物冶炼铁。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19kJ/mol
请写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____。
(2)11.2gFe与一定量的HNO3充分反应后,Fe全部溶解,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水槽中,气体恰好被完全吸收,O2的物质的量是____。
(3)利用电解实验可以制得纯净的Fe(OH)2,装置如图所示,两电极分别是石墨和铁,电解质溶液为NaCl溶液。
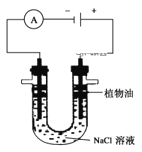
①植物油的作用是___,在加入植物油之前,要对NaCl溶液作何处理:____。
②阳极的电极反应式为____。
③若将该装置改为防止Fe发生电化学腐蚀的装置,则Fe电极应与电源____极相连,当电路中通过2mol电子时,两极共收集到气体___L(标准状况)。
【答案】FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-11kJ/mol 0.14mol 起到隔绝空气的作用 要将NaCl溶液加热煮沸,除去溶解氧气 Fe-2e=Fe2+ 阴 44.8L
【解析】
(1)根据盖斯定律解答;
(2)根据氧化还原反应中电子守恒规律解答;
(3)根据电解原理,阳极发生氧化反应,阴极发生还原反应进行解答。
(1)由已知①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol;②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47kJ/mol;③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19kJ/mol,根据盖斯定律,由(①![]() 3-②-③
3-②-③![]() 2)
2)![]() 可得:FeO(s)+CO(g)=Fe(s)+CO2(g) △H=(-25kJ/mol
可得:FeO(s)+CO(g)=Fe(s)+CO2(g) △H=(-25kJ/mol![]() 3+47kJ/mol-19kJ/molx2)
3+47kJ/mol-19kJ/molx2)![]() =-11kJ/mol;答案:FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-11kJ/mol;
=-11kJ/mol;答案:FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-11kJ/mol;
(2)根据两个反应过程,利用得失电子守恒,知铁失电子总数等于氧气得电子总数,故2n(Fe2+)+3n(Fe3+)=4n(O2),而n(Fe2+)=![]() n(Fe)=0.04mol,n(Fe3+)=
n(Fe)=0.04mol,n(Fe3+)=![]() n(Fe)=0.16mol,则n(O2)=
n(Fe)=0.16mol,则n(O2)=![]() (0.04
(0.04![]() 2+0.16
2+0.16![]() 3)mol=0.14mol;答案:0.14mol;
3)mol=0.14mol;答案:0.14mol;
(3)①Fe(OH)2易被空气中氧气氧化,植物油密度小,浮在液面上可以起到隔绝空气的作用;在加入植物油之前,需要将NaCl溶液加热煮沸,除去溶解氧气。答案:起到隔绝空气的作用;要将NaCl溶液加热煮沸,除去溶解氧;
②本实验目的是通过电解实验制得纯净的Fe(OH)2,所以阳极应为Fe放电,电极反应式为Fe-2e=Fe2+;答案:Fe-2e=Fe2+;
③利用电解原理保护铁,则Fe应作阴极,与电源负极相连,此时为电解NaCl溶液,根据2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,知电路中通过2mol电子时,两极共收集到2mol气体,在标准状况下的体积为44.8L。答案:阴;44.8L。
2NaOH+H2↑+Cl2↑,知电路中通过2mol电子时,两极共收集到2mol气体,在标准状况下的体积为44.8L。答案:阴;44.8L。

【题目】关于有机反应类型的以下判断不正确的是( )
选项 | 有机反应 | 反应类型 |
A | 苯与H2反应生成环己烷 | 加成反应 |
B | 甲烷与氯气混合光照爆炸 | 取代反应 |
C | 乙烯与溴的CCl4溶液反应 | 取代反应 |
D | 乙烯使酸性高锰酸钾溶液褪色 | 氧化反应 |
A.AB.BC.CD.D