题目内容
3.二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,由钛铁矿制取二氧化钛,常用硫酸法,其流程如下: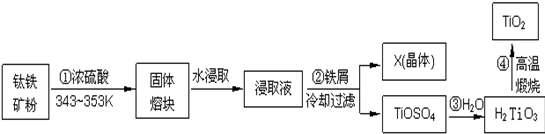
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O.
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,适宜的条件还可以选择熔块粉碎(或连续搅拌、适当升高温度等).(任写一种均可)
(3)浸取液与铁屑反应的离子方程式为2Fe3++Fe=3Fe2+;从滤液中获得晶体X的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)第③步反应化学方程式TiOSO4+2H2O=H2TiO3+H2SO4.
(5)取少量H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
分析 钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,在343K-353K条件下钛铁矿和浓硫酸混合,发生的反应有FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,得到固体熔块,然后用水浸取,浸取液中含有Fe3+,Fe3+能和Fe反应生成Fe2+,然后过滤,得到的晶体X成分为硫酸亚铁,TiOSO4能发生水解反应生成H2TiO3和H2SO4,最后高温煅烧得到TiO2,
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式;
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法;
(3)铁离子具有氧化性,能被Fe还原;从溶液中得到晶体采用蒸发浓缩、冷却结晶方法;
(4)TiOSO4能发生水解反应生成H2TiO3和H2SO4,根据反应物和生成物书写方程式;
(5)Fe2+和KSCN不反应,Fe3+能和KSCN反应生成络合物硫氰化铁而使液体呈血红色;Fe3+水解生成Fe(OH)3,Fe(OH)3煅烧生成Fe2O3.
解答 解:钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有Fe2O3、SiO2等杂质,在343K-353K条件下钛铁矿和浓硫酸混合,发生的反应有FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,得到固体熔块,然后用水浸取,浸取液中含有Fe3+,Fe3+能和Fe反应生成Fe2+,然后过滤,得到的晶体X成分为硫酸亚铁,TiOSO4能发生水解反应生成H2TiO3和H2SO4,最后高温煅烧得到TiO2,
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法,即采用将熔块粉碎(或连续搅拌、适当升高温度等)方法,
故答案为:熔块粉碎(或连续搅拌、适当升高温度等);
(3)铁离子具有氧化性,能被Fe还原,离子方程式为;从溶液中得到晶体采用蒸发浓缩、冷却结晶方法,
故答案为:2Fe3++Fe=3Fe2+;蒸发浓缩;冷却结晶;
(4)TiOSO4能发生水解反应生成H2TiO3和H2SO4,根据反应物和生成物书写方程式为TiOSO4+2H2O=H2TiO3+H2SO4,故答案为:TiOSO4+2H2O=H2TiO3+H2SO4;
(5)Fe2+和KSCN不反应,Fe3+能和KSCN反应生成络合物硫氰化铁而使液体呈血红色,双氧水能氧化亚铁离子生成铁离子而导致后来溶液呈血红色,根据现象知溶液中存在的离子是Fe2+;Fe3+水解生成Fe(OH)3,Fe(OH)3煅烧生成Fe2O3,氧化铁呈红棕色,所以发黄的杂质是Fe2O3,
故答案为:Fe2+;Fe2O3.
点评 本题以物质分离和提纯和制备为载体考查化学工艺流程,涉及离子检验、水解反应、氧化还原反应、基本操作及化学反应速率影响因素等知识点,明确化学原理及物质性质是解本题关键,会从整体上分析解答,题目难度不大.

| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 | |
| C. | 钢铁腐蚀时负极的电极反应式:Fe-3e-═Fe+ | |
| D. | 工业上电解饱和食盐水时阴极的电极反应式:2H++2e-═H2↑ |
| A. | 氧化剂只有KNO3 | B. | C发生还原反应 | C. | KNO3被氧化 | D. | S得到了电子 |
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2Na2HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | Zn+H2SO4═ZnSO4+H2↑ |
| A. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| B. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
| A. | 热化学方程式中,化学式前面的化学计量数只能表示物质的量 | |
| B. | 1 moL H2生成1 mol H20时放出的热量就是氢气的燃烧热的值 | |
| C. | 用1mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值 | |
| D. | 条件相同,用16g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同 |
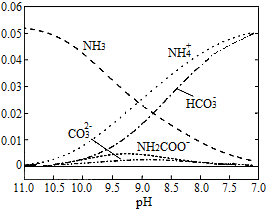 ,
,下列说法不正确的是( )
| A. | 在pH=8.0 时,c(NH4+)>c(HCO3-)>c(NH2COO-)=c(CO32-) | |
| B. | 随着C02的不断通入,Kw不变,但是水的电离受到促进 | |
| C. | 在溶液中pH不断降低的过程中,最终产物中含有NH2COO- | |
| D. | D、随着C02的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}{H}_{2}O)}$ 不断减小 |
| A. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO | B. | Fe+H2SO4═FeSO4+H2↑ | ||
| C. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
| A. | MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | CH≡CH$→_{催化剂△}^{HCl}$CH2=CHCl$→_{△}^{催化剂}$ | |
| C. | HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{NaOH}^{CH_{2}OH}$HCOOCH3 | |
| D. | CH2═CH2$→_{催化剂△}^{O_{2}}$CH3CHO$→_{△}^{银氨溶液}$CH3COOH |