题目内容
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据下表中数据,画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是 ;
(3)列式计算该反应在0min~3min时间内v(Z)═ ;(保留至小数点后三位)
(4)该反应达到平衡时反应物X的转化率等于 .

| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(2)体系中发生反应的化学方程式是
(3)列式计算该反应在0min~3min时间内v(Z)═
(4)该反应达到平衡时反应物X的转化率等于
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,9min后各物质的物质的量不再变化,且反应物不为0,
(2)根据物质的量的变化得出反应物和生成物,再根据物质的量变化量之比等于化学计量数之比,得到化学方程式;
(3)依据化学反应速率=
,结合图表数据计算;
(4)根据转化率等于变化量和初始量的比值来计算回答.
(2)根据物质的量的变化得出反应物和生成物,再根据物质的量变化量之比等于化学计量数之比,得到化学方程式;
(3)依据化学反应速率=
| △c |
| △t |
(4)根据转化率等于变化量和初始量的比值来计算回答.
解答:
解:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,所以X、Y、Z在相同时间内的变化量之比为1:2:2,9min后各物质的物质的量不再变化,平衡时X、Y、Z的物质的量分别为:0.55mol、0.1mol、0.9mol.
横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为: ,故答案为:
,故答案为: ;
;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为X+2Y?2Z,
故答案为:X+2Y?2Z;
(3)0-3min内Z的反应速率为
=
=0.083mol/(L?min),故答案为:0.083mol/(L?min);
(4)该反应达到平衡时反应物X的转化率等于
×100%=45%,故答案为:45%.
横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:
 ,故答案为:
,故答案为: ;
;(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为X+2Y?2Z,
故答案为:X+2Y?2Z;
(3)0-3min内Z的反应速率为
| △c |
| △t |
| ||
| 3min |
(4)该反应达到平衡时反应物X的转化率等于
| 1.0-0.55 |
| 1.0 |
点评:本题考查化学平衡移动、外界条件对平衡的影响、化学平衡图象,反应速率、转化率的计算应用等,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
相关题目
用CH4催化还原NOx,可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1
下列说法不正确的是( )
下列说法不正确的是( )
| A、若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ |
| B、由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574 kJ?mol-1 |
| C、反应①②转移的电子数不同 |
| D、反应①②均为放热反应 |
下列实验操作能达到预期目的是( )
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
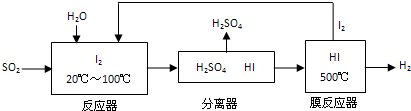
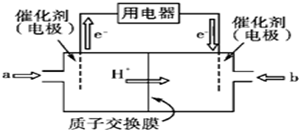
 (1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为
(1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为