题目内容
2.体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082(空气的平均摩尔质量为29g/mol).则容器中HCl气体的体积为( )| A. | 0.25L | B. | 0.5L | C. | 0.75L | D. | 1L |
分析 容器中的气体相对氧气的密度为1.082,则气体的平均相对分子质量为1.082×32=34.6,令HCl的体积分数为x,则空气的体积分数为(1-x),根据平均相对分子质量计算x的值,进而计算HCl的质量分数.
解答 解:容器中的气体相对氧气的密度为1.082,则气体的平均相对分子质量为:1.082×32=34.6,
令HCl的体积分数为x,则空气的体积分数为(1-x),则:36.5x+29(1-x)=34.6,
解得:x=0.75
所以容器中HCl气体的体积为:1L×0.75=0.75L,
故选C.
点评 本题考查阿伏伽德罗定律及推论、化学计算等,题目难度中等,根据平均相对分子质量计算HCl的体积分数是关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
1.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液, 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
| B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油, 放入无水乙醇中,产生气泡 | Na能置换出醇烃基中的氢 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体一定是SO2 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
13.下列溶液中的氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )
| A. | 150mL 1mol/L NaCl溶液 | B. | 75mL 3mol/L NH4Cl溶液 | ||
| C. | 150mL 2mol/L KCl溶液 | D. | 75mL 2mol/L CaCl2溶液 |
17.充分燃烧一定量的丁烷气体放出的热量为xQ kJ,完全吸收它生成的CO2生成正盐,需5mol•L-1的KOH溶液100mL,则丁烷的燃烧热为( )
| A. | 16xQ kJ•mol-1 | B. | 8xQ kJ•mol-1 | C. | 4xQ kJ•mol-1 | D. | 2xQ kJ•mol-1 |
7.下列有关分子、原子、离子说法正确的是( )
| A. | 分子是化学变化中最小的粒子 | |
| B. | 一切原子的原子核都是由质子、中子构成的 | |
| C. | 分子的质量总比原子质量大 | |
| D. | 分子、原子、离子都能直接构成物质 |
14.利用有机物X可制取有机物Y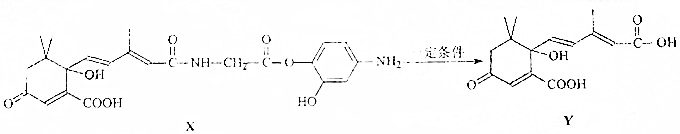
下列说法正确的是( )

下列说法正确的是( )
| A. | X分子中有2个手性碳原子 | |
| B. | X可以发生酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| C. | 1molX与足量NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molY在一定条件下与H2发生加成反应,最多消耗5molH2 |
11.部分弱酸的电离常数如表:
下列有关说法不正确的是( )
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 等体积、等浓度的HCOONa和NaCN两溶液中所含阴离子数目相等 | |
| B. | HCOO-、CN-、HS-在溶液中可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+C(S2-) | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
19.影响气体体积的微观因素主要有( )
| A. | 微粒大小和数目 | B. | 微粒数目和间距 | C. | 微粒间距和大小 | D. | 以上说法都不对 |