题目内容
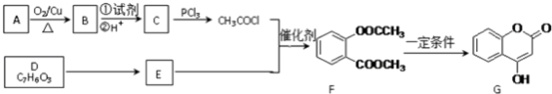
14.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图.下列有关说法错误的是( )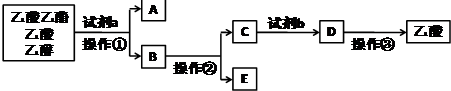
| A. | 操作①用到的玻璃仪器主要有分液漏斗、烧杯 | |
| B. | 工业制备无水E物质的方法是在E中加生石灰后进行操作② | |
| C. | 试剂b可用硫酸 | |
| D. | 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸 |
分析 由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入a为饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,操作①为分液可分离油层和水层;对水层中的乙酸钠和乙醇进一步分离时应采取操作②为蒸馏分离出乙醇;然后水层中的乙酸钠,根据强酸制弱酸,加试剂b为浓硫酸反应得到乙酸,再进行操作③蒸馏得到乙酸,
A.操作①为分液,用到的玻璃仪器主要有分液漏斗、烧杯,故A正确;
B.由上述分析可知,E为乙醇,E中加生石灰后进行操作②蒸馏即可,故B正确;
C.由上述分析可知,试剂b可用硫酸,故C正确;
D.操作③为蒸馏,不需要漏斗等过滤装置中的仪器,故D错误;
故选D.
点评 本题考查混合物分离提纯方法的实验设计,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列关于焰色反应的说法正确的是( )
| A. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+,无K+ | |
| B. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| C. | 进行钠的焰色反应实验,可用到的实验用品有:铂丝、氯化钠溶液、稀盐酸 | |
| D. | 焰色反应是某些金属单质具有的性质 |
19.镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
再利用浓海水提镁的一段工艺流程如下图:
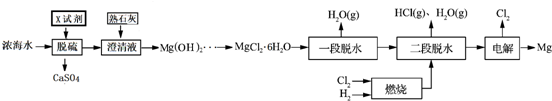
请回答下列问题
(1)浓海水主要含有的四种离子中质量浓度最小的是Mg2+.在上述流程中,可以循环使用的物质是Cl2、HCl.
(2)在该工艺过程中,X试剂的化学式为CaCl2.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为84672g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl═MgCl2+V2O4•Li2O 该电池的正极反应式为V2O5+2Li++2e-=V2O4•Li2O.
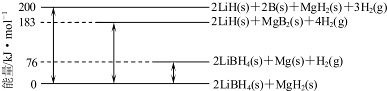
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s)═MgB2(s)△H=-93 kJ•mol-1.
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |

请回答下列问题
(1)浓海水主要含有的四种离子中质量浓度最小的是Mg2+.在上述流程中,可以循环使用的物质是Cl2、HCl.
(2)在该工艺过程中,X试剂的化学式为CaCl2.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为84672g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl═MgCl2+V2O4•Li2O 该电池的正极反应式为V2O5+2Li++2e-=V2O4•Li2O.
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s)═MgB2(s)△H=-93 kJ•mol-1.

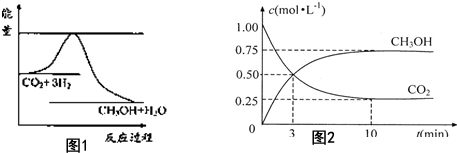 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)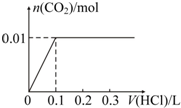
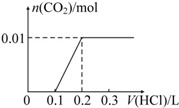
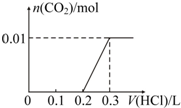
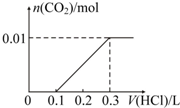
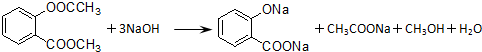 .
.
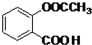 .
.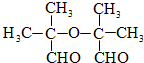 .
.
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
. .
.