题目内容
18.下列说法中正确的是( )| A. | 两个原子或多个原子之间的相互作用叫做共价键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 分子晶体中一定含有共价键,离子晶体中一定含有离子键 | |
| D. | 氯化钠晶体中含有阳离子,氯化钠溶液中也含有阳离子 |
分析 A.相邻的原子之间强烈的相互作用叫做化学键;
B.离子之间的静电作用形成离子键;
C.单原子分子中没有化学键;
D.氯化钠属于离子化合物.
解答 解:A.相邻的原子之间强烈的相互作用叫做化学键,形成化学键的原子必须是相邻的原子,且其之间的作用力必须强烈,故A错误;
B.离子键是阴、阳离子间通过静电作用而形成的,是吸引力和排斥力的平衡,故B错误;
C.单原子分子中没有化学键,如稀有气体为单原子分子,形成的晶体中没有共价键,故C错误;
D.氯化钠属于离子化合物,在晶体中或溶液中均存在阳离子,故D正确;
故选D.
点评 本题考查化学键,侧重离子键、共价键的形成及常见化合物中的化学键的考查,注意利用实例分析选项C,注重基础知识的训练,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
8.下列事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 | |
| B. | 在MgCl2 与AlCl3 溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 | |
| C. | 硫酸和硅酸钠溶液反应产生白色沉淀,判断硫与硅的非金属活动性强弱 | |
| D. | Br2 与I2 分别与足量的H2 反应,判断溴与碘的非金属活动性强弱 |
9.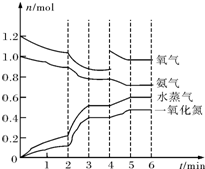 在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
 在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )| A. | 充入了O2(g) | B. | 降低温度 | C. | 加了催化剂 | D. | 扩大了容器体积 |
6.实验室检验硫酸亚铁溶液是否变质,选择的试剂是( )
| A. | HCl | B. | AgN03 | C. | KSCN | D. | KCN |
13.下列说法中正确的是( )
| A. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| B. | 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 | |
| C. | 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 | |
| D. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 |
10.两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6:1:4.完全燃烧0.1mol A能生成3.6g水.B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7g Ag.则下列关于物质A和物质B的判断正确的是( )
| A. | 物质A一定是乙醛 | |
| B. | 物质B的分子式为C4H8O2 | |
| C. | 物质B的同分异构体中既含有醛基又含有羟基的共有6种 | |
| D. | 物质A和物质B互为同分异构体 |
7.下列说法错误的是( )
| A. | 安装燃煤“固硫”装置,可以降低酸雨发生率 | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 研发易降解塑料,防止白色污染 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
 ;
;