题目内容
16.日常生活中常用的“84消毒液”的主要成分是NaClO,将0.5mol•L-1的NaClO溶液和1mol•L-1的FeCl2溶液等体积混合时二者恰好反应完,最后得到红棕色沉淀及棕黄色溶液,则还原产物是NaCl.分析 NaClO具有强的氧化性,能够氧化二价铁离子生成三价铁,根据得失电子守恒结合0.5mol•L-1的NaClO溶液和1mol•L-1的FeCl2溶液等体积混合时二者恰好反应计算判断;
解答 解:NaClO具有强的氧化性,能够氧化二价铁离子生成三价铁,又因为0.5mol•L-1的NaClO溶液和1mol•L-1的FeCl2溶液等体积混合时二者恰好反应,则NaClO溶液和FeCl2按照物质的量之比1:2反应,根据得失电子守恒,则NaClO降低2价即生成氯化钠,离子方程式为:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-;所以还原产物是NaCl;
故答案为:NaCl;
点评 本题考查了氧化还原反应原理,明确氧化还原反应得失电子守恒是解题关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
8.下列说法正确的是( )
| A. | 含醛基的有机物一定能发生银镜反应 | |
| B. | 在氧气中燃烧时,只生成CO2和H2O的物质一定是烃 | |
| C. | 苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸 | |
| D. | 在酯化反应中,羧酸脱去羧基中的氢,醇脱去羟基而生成水和酯 |
4.某溶液中含有大量的Cl-、CO32-两种阴离子,如果只取一次该溶液就能够分别将两种阴离子检验出来,下列实验操作顺序正确的是( )
①过滤;②滴加AgNO3溶液;③滴加过量Ba(NO3)2溶液.
①过滤;②滴加AgNO3溶液;③滴加过量Ba(NO3)2溶液.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ③①② |
11.用NA表示阿伏加德罗常数的值,下列叙述中确的是( )
| A. | 7gCnH2n中含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCHCl3中含原子总数等于5NA | |
| C. | 1molC5H12分子中所含单键数为15NA | |
| D. | 标准状况下,11.2L已烷中含3mol碳原子 |
19.下列装置中能组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  |
 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.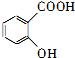 .
. .
. 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).


 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是