题目内容
16.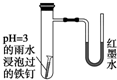 如图所示是探究铁发生腐蚀的装置图.发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升.下列说法不正确的是( )
如图所示是探究铁发生腐蚀的装置图.发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升.下列说法不正确的是( )| A. | 两种腐蚀负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 开始时发生的是析氢腐蚀 | |
| C. | 一段时间后发生的是吸氧腐蚀 | |
| D. | 析氢腐蚀的总反应式为2Fe+O2+2H2O═2Fe(OH)2 |
分析 pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,导致试管内气体压强增大;亚硫酸根离子能被氧气氧化生成硫酸根离子,导致试管内气体压强减小.
解答 解:A.无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe-2e-═Fe2+,故A正确;
B.PH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故B正确;
C.一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故C正确;
D.析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,故D错误;
故选D.
点评 本题考查了原电池原理,明确钢铁发生析氢腐蚀和吸氧腐蚀所需溶液的酸碱性是解本题的关键,根据析氢腐蚀和吸氧腐蚀导致试管内气体压强的变化即可分析解答,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
19.下列溶液中有关离子浓度关系正确的是( )
| A. | 25℃时pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+) | |
| B. | Na2CO3和NaHCO3混合溶液中一定有:c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+c(Na+) | |
| C. | pH=4的0.1mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 将①pH=2的CH3COOH溶液、②pH=2的盐酸、③0.01mol/L的氨水、④0.01mol/L的NaOH溶液,分别稀释100倍后溶液中的c(H+):②>①>④>③ |
1.下列冶炼金属的方法错误的是( )
| A. | 加热氧化银制银 | B. | 电解熔融氧化铝制铝 | ||
| C. | 铁与硫酸铜溶液反应制铜 | D. | 加热铝与氧化镁混合物制镁 |
8.关于苯和苯酚的叙述中正确的是( )
| A. | 实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 | |
| D. | 实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗 |
6.现有部分短周期元素的性质或原子结构如下表
(1)元素T的阴离子的结构示意图 .
.
(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其化合物的种类最多且其氢化物是一种清洁能源 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价+7价 |
 .
.(2)元素Y在周期表中的位置是第二周期ⅤA族.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示).下列表述中能证明这一事实的是bce.
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物笔比T的氢化物溶解度大
e.Z的单质与H2化合比T的单质与H2化合更容易
(4)结合所学的知识,请设计一个与(3)中的事实不同的实验方案证明元素Z与元素T的非金属性的强弱将氯气通入到Na2S溶液中,若产生淡黄色沉淀,则证明非金属性Cl>S.