题目内容
合成以氯化钠和乙炔为原料合成聚氯乙烯.请设计合成路线 (无机试剂及溶剂任选).
注:合成路线的书写格式参照如下示例流程图:CH3CHO
CHC3OOH
CHC3OOCH2CH3.
注:合成路线的书写格式参照如下示例流程图:CH3CHO
| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
考点:有机物的合成
专题:有机物的化学性质及推断
分析:以氯化钠和乙炔为原料合成聚氯乙烯,可以先电解饱和食盐水得H2和Cl2,Cl2和H2反应生成HCl,HCl与乙炔发生加反应生成CH2=CHCl,CH2=CHCl发生加聚反应得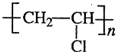 ,据此答题.
,据此答题.
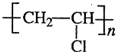 ,据此答题.
,据此答题.解答:
解:以氯化钠和乙炔为原料合成聚氯乙烯,可以先电解饱和食盐水得H2和Cl2,Cl2和H2反应生成HCl,HCl与乙炔发生加反应生成CH2=CHCl,CH2=CHCl发生加聚反应得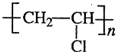 ,合成路线为
,合成路线为 ,
,
故答案为: .
.
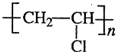 ,合成路线为
,合成路线为 ,
,故答案为:
 .
.
点评:本题考查了聚氯乙烯的制备,涉及到有机和无机相结合的知识,都是基础知识,答题时要注意基础知识的灵活运用,可以根据课本知识完成,本题难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
周期表中14号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是( )
| A、电子数 | B、最外层电子数 |
| C、电子层数 | D、次外层电子数 |
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、少量CO2通入Ca(ClO)2溶液生成CaCO3,则少量SO2通入Ca(ClO)2溶液生成CaSO3 |
| C、硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中 |
| D、镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
NaCl溶液中含有可溶性的CaCl2、MgCl2、Na2SO4杂质.现欲除去杂质,得到纯净的NaCl溶液,则加入试剂的顺序不正确的是( )
| A、BaCl2→NaOH→Na2CO3→HCl |
| B、BaCl2→Na2CO3→NaOH→HCl |
| C、NaOH→BaCl2→Na2CO3→HCl |
| D、Na2CO3→BaCl2→NaOH→HCl |


 的同分异构体,写出其满足下列条件的结构简式:
的同分异构体,写出其满足下列条件的结构简式:



