题目内容
17.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:下列说法不正确的是( )| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 /mol-3•L3 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 mol3•L-3 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| D. | 在80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
分析 A.由表中数据可知,温度越高,K越小;
B.互为逆反应时,K为倒数关系;
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,Qc=$\frac{0.5}{0.{5}^{4}}$=8>K=2,平衡逆向移动;
D.80℃达到平衡时,测得n(CO)=0.3 mol,c(CO)=$\frac{0.3mol}{0.3L}$=1mol/L,设Ni(CO)4的平衡浓度为x,则$\frac{x}{{1}^{4}}$=2.
解答 解:A.由表中数据可知,温度越高,K越小,则生成Ni(CO)4(g)的反应为放热反应,故A正确;
B.互为逆反应时,K为倒数关系,则25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为$\frac{1}{5×1{0}^{4}}$=2×10-5 mol3•L-3,故B正确;
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,Qc=$\frac{0.5}{0.{5}^{4}}$=8>K=2,平衡逆向移动,则此时v正<v逆,故C错误;
D.80℃达到平衡时,测得n(CO)=0.3 mol,c(CO)=$\frac{0.3mol}{0.3L}$=1mol/L,设Ni(CO)4的平衡浓度为x,则$\frac{x}{{1}^{4}}$=2,解得x=2mol/L,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握K与温度的关系、K的计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意表格数据的分析与应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.有X、Y、Z、M、G五种原子序数依次增大的短周期元素,其性质或原子结构如表所示.下列有关说法正确的是
( )
( )
| 编号 | 元素性质或原子结构 |
| X | X的某一种原子没有中子 |
| Y | 最高正价与最低负价的代数和为0 |
| Z | 最外层电子数是周期数的3倍 |
| M | 含M元素的物质,其焰色反应为黄色 |
| G | G的简单离子半径在同周期中最小 |
| A. | X是组成有机物的必需元素 | |
| B. | Y、Z所形成的氢化物分子均含有10个电子 | |
| C. | Z的简单离子半径大于G的简单离子半径 | |
| D. | G的氧化物不溶于M的最高价氧化物所对应的水化物的水溶液 |
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式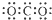 | B. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | ||
| C. | 乙烯的结构简式C2H4 | D. | Cl-的结构示意图: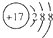 |
12.已知,常温常压下,过氧化钠(N2O2)是一种固体.标准状况下,等物质的量的N2O2和O2中相同的是( )
| A. | 两种物质中所含的氧原子数 | B. | 两种物质中所含的氧分子数 | ||
| C. | 两种物质的体积 | D. | 两种物质的质量 |
2.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法正确的是( )


| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同 |
9.下列各组物质相互混合反应,既有气体生成,最终又一定有沉淀生成是( )
①金属钠投入FeCl3溶液中 ②少量电石投入过量碳酸氢钠溶液中
③过氧化钠投入AlCl3溶液中 ④碳酸钠投入明矾溶液中.
①金属钠投入FeCl3溶液中 ②少量电石投入过量碳酸氢钠溶液中
③过氧化钠投入AlCl3溶液中 ④碳酸钠投入明矾溶液中.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
6.质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中后,质量大于ag的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 澄清石灰水 | D. | 硫酸 |