题目内容
4.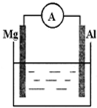 如图所示装置:
如图所示装置:(1)若烧杯中溶液为稀硫酸,则观察到的现象为镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转.两极反应式为:正极2H++2e-=H2↑;负极Mg-2e-=Mg2+.
(2)若烧杯中溶液为氢氧化钠溶液,则溶液中OH-移向Al棒.镁棒上发生的电极反应式为2H2O+2e-=H2+2OH-总反应的离子方程为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 (1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,Al和NaOH、H2O反应生成NaAlO2、H2.
解答 解:(1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑,所以看到的现象是:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,
故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;
(2)若烧杯中溶液为氢氧化钠溶液,碱性条件下,Al易失电子作负极、Mg作正极,负极反应式为Al+4OH--3e-═AlO2-+2H2O,正极反应式为2H2O+2e-=H2↑+2OH-,电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2H2O+2e-=H2+2OH-;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 电极反应式的书写要注意结合电解质溶液酸碱性、物质的性质,不能根据金属的活泼性强弱判断正负极,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列有机物的命名正确的一项是( )
| A. | (CH3)2CHCH(CH3)2:2-二甲基丁烷 | B. | CH3CH(OH)CH(CH3)2:3-甲基-2-丁醇 | ||
| C. | 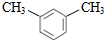 :1,4-二甲苯 :1,4-二甲苯 | D. | 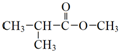 :正丁酸甲酯 :正丁酸甲酯 |
19.下列装置中能组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列物质的化学名称分别是:Na2S2O3叫硫代硫酸钠;CaSx 叫多硫化钙;BaO2叫过氧化钡.根据上述命名规律,K2CS3应读作( )
| A. | 三硫代碳酸钾 | B. | 多硫碳化钾 | C. | 过硫碳酸钾 | D. | 超硫碳酸钾 |
13.下列物质中存在离子键和非极性键的是( )
| A. | NaOH | B. | NH4Cl | C. | CaC2 | D. | H2O2 |
14.下列说法正确的是( )
| A. | 取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| B. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色,然后蘸取溶液 | |
| C. | 在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |