题目内容
2.下列离子方程式书写正确的是( )| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
分析 A.电荷不守恒;
B.反应生成碳酸钙和氢氧化钙和水;
C.电荷不守恒;
D.不符合反应客观事实.
解答 解:A.FeCl2溶液中通入Cl2,离子方程式:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.澄清石灰水与少量小苏打溶液混合,离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O,故B正确;
C.金属铝溶于氢氧化钠溶液,离子方程式:2Al+2H2O+2OH-=2AlO2-+3H2↑,故C错误;
D.氨水中的一水合氨是弱电解质要写成分子式的形式,所以向AlCl3溶液中加入过量的氨水,其离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:B.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
16.含一个双键的烯烃,与氢气加成后的产物结构简式如图,此烯烃可能有的结构有( )

| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
10. 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O
 +HCl→
+HCl→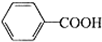 ↓+KCl
↓+KCl
相关资料:
实验步骤:
如图组装反应装置(冷凝水.夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9,.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌,加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)本实验应选择的三颈烧瓶规格为B(填字母序号).
A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯已完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用B法.
A.蒸发 B.升华 C.过滤 D.分液
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25,.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL、V2=24.80mL、V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为99.00%.
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→ ↓+KCl
↓+KCl相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
如图组装反应装置(冷凝水.夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9,.4g高锰酸钾和3.0mL甲苯.
②将三颈烧瓶中的混合液体搅拌,加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)本实验应选择的三颈烧瓶规格为B(填字母序号).
A.100mL B.250mL C.500mL D.1000mL
(2)判断甲苯已完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用B法.
A.蒸发 B.升华 C.过滤 D.分液
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25,.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL、V2=24.80mL、V3=25.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为99.00%.
7.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R的离子结构示意图是 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为O2、O3.
(3)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(4)Y与R相比,非金属性较强的元素是Cl,下列事实能证明这一结论的是BC(选填字母序号).
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR>YX4
C.Y与R形成的化合物中Y呈正价 D.在水中的溶解性:X4YM4<XRM4
(5)下列现象或应用与电子在不同能级的轨道上跃迁有关的是ABD.
A.X原子有四种可见光谱谱线 B.Z元素焰色反应呈黄色
C.Y单质可做半导体材料 D.Q单质与氧化铁在高温下剧烈反应并发光、发热.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.(2)M元素的常见单质有二种,它们互称同素异形体,它们的化学式为O2、O3.
(3)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(4)Y与R相比,非金属性较强的元素是Cl,下列事实能证明这一结论的是BC(选填字母序号).
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR>YX4
C.Y与R形成的化合物中Y呈正价 D.在水中的溶解性:X4YM4<XRM4
(5)下列现象或应用与电子在不同能级的轨道上跃迁有关的是ABD.
A.X原子有四种可见光谱谱线 B.Z元素焰色反应呈黄色
C.Y单质可做半导体材料 D.Q单质与氧化铁在高温下剧烈反应并发光、发热.
14.除去乙酸乙酯中的乙酸最好的方法是( )
| A. | 用水洗 | B. | 用盐酸洗 | ||
| C. | 用氢氧化钠溶液洗 | D. | 用饱和Na2CO3溶液 |
 .
. ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形. 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.