题目内容
8.将标准状况下的某气体(摩尔质量为M g/mol)溶于a g水中,所得溶液的密度为b g/cm3,物质的量浓度为c mol/L,则该气体溶入水中的体积是( )| A. | $\frac{22.4ac}{M?1-c?}$ L | B. | $\frac{22.4c}{M}$ L | ||
| C. | $\frac{22.4ac}{1000b-Mc}$ L | D. | $\frac{22.4ac}{1000b}$ L |
分析 令该气体的体积为VL,计算出气体的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,根据n=cV表示出该气体的物质的量,根据气体物质的量相等列方程计算.
解答 解:令气体的体积为VL,则:
该气体物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该气体质量为$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,
故溶液的质量为ag+$\frac{VM}{22.4}$g=(a+$\frac{VM}{22.4}$)g,
溶液的体积为$\frac{(a+\frac{VM}{22.4})g}{1000bg/L}$=$\frac{22.4a+VM}{22400b}$,
所以VL=$\frac{22.4a+VM}{22400b}$×cmol/L×22.4L/mol,
解得V=$\frac{22.4ac}{1000b-Mc}L$,故选C.
点评 本题考查物质的量浓度的计算,难度中等,注意对公式的理解与灵活运用.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
18.某有机化合物的结构简式如图所示.有关该化合物的叙述不正确的是( )
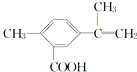

| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1 mol该物质最多能与4 mol H2发生加成反应 | |
| C. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 | |
| D. | 该有机物在一定条件下,可以发生取代、氧化、酯化反应 |
19.某研究性学习小组对铝热反应(以铝和氧化铁反应为例)实验进行研究.已知Al、A12O3、Fe、Fe2O3的熔点、沸点数据如表所示:
请回答下列问题:
(1)铝热反应是氧化还原反应,在反应中金属铝被氧化 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下实验方案来验证:取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加KSCN溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则:该同学的实验方案是否合理:不合理(填“合理”或“不合理”),
若不合理,原因是Fe3+易被Fe、Al还原成Fe2+ (若合理则不用填写).
(4)把7.47g熔融物(主要含有Fe和少量Fe2O3、A1)投入 140mL1.00mol•L-1稀硫酸(足量)充分反应,将反应后的混合液分成两等份,向其中一份滴加KSCN溶液,溶液不变色,向另一份中滴加2.00mol•L-1的NaOH溶液,当加入2.5mL时开始产生沉淀,加入NaOH溶液的体积与所得沉淀质量数据如表:(不考虑空气对沉淀的影响)
①当NaOH溶液体积为70mL时沉淀量达到最大.
②求1.29g沉淀中各成分的质量.(写出计算过程)
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------- |
(1)铝热反应是氧化还原反应,在反应中金属铝被氧化 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下实验方案来验证:取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加KSCN溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则:该同学的实验方案是否合理:不合理(填“合理”或“不合理”),
若不合理,原因是Fe3+易被Fe、Al还原成Fe2+ (若合理则不用填写).
(4)把7.47g熔融物(主要含有Fe和少量Fe2O3、A1)投入 140mL1.00mol•L-1稀硫酸(足量)充分反应,将反应后的混合液分成两等份,向其中一份滴加KSCN溶液,溶液不变色,向另一份中滴加2.00mol•L-1的NaOH溶液,当加入2.5mL时开始产生沉淀,加入NaOH溶液的体积与所得沉淀质量数据如表:(不考虑空气对沉淀的影响)
| V (NaOH)mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| m(沉淀)/g | 1.29 | 3.09 | 4.89 | 5.4 | 5.4 |
②求1.29g沉淀中各成分的质量.(写出计算过程)
16.下列有关化学反应与能量关系的说法错误的是( )
| A. | 弱电解质的电离是一个吸热的过程 | |
| B. | 化学反应中的能量变化不仅仅表现为热量变化 | |
| C. | 反应物的总能量大于生成物的总能量的反应是吸热反应 | |
| D. | 断裂化学键吸收能量,形成化学键放出能量 |
20.三氯甲烷(CHCl3)又称氯仿,可用作麻醉剂,但在光照条件下易被氧化成剧毒的(COCl2).其反应式为2CHCl3+O2 $\stackrel{光}{→}$2COCl2+2HCl,为防止事故发生,在使用三氯甲烷前要检验一下其是否变质,检验用的最佳试剂是( )
| A. | NaOH溶液 | B. | 溴水 | C. | AgNO3溶液 | D. | 淀粉碘化钾溶液 |
17.四川有丰富的天然气资源.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关说法不正确的是( )
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
18.过量的下列溶液与水杨酸 反应能得到化学式为C7H4O3Na2的是( )
反应能得到化学式为C7H4O3Na2的是( )
 反应能得到化学式为C7H4O3Na2的是( )
反应能得到化学式为C7H4O3Na2的是( )| A. | NaHCO3溶液 | B. | Na2CO3溶液 | C. | NaOH溶液 | D. | NaCl溶液 |

 、
、 .
. ;
; ②D与浓溴水反应
②D与浓溴水反应
 .
.