题目内容
能正确表示下列反应的离子方程式的是( )
| A、将Cl2通入氯化亚铁溶液:Fe2++Cl2=Fe3++2Cl- |
| B、铜与浓硝酸的反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O |
| C、Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| D、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据电荷守恒进行判断,该离子方程式两边电荷不守恒;
B.浓硝酸在离子方程式中需要拆开,不能写成分子式;
C.氢氧化钠过量,碳酸根离子过量,反应生成碳酸钙沉淀和碳酸根离子;
D.氯气足量,亚铁离子和溴离子完全被氧化.
B.浓硝酸在离子方程式中需要拆开,不能写成分子式;
C.氢氧化钠过量,碳酸根离子过量,反应生成碳酸钙沉淀和碳酸根离子;
D.氯气足量,亚铁离子和溴离子完全被氧化.
解答:
解:A.Cl2通入氯化亚铁溶液,离子方程式必须遵循电荷守恒,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.Cu与浓硝酸的反应,离子方程式中浓硝酸应该写成离子形式,正确的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故B错误;
C.Ca(HCO3)2溶液与过量NaOH溶液反应,反应产物中碳酸根离子过量,正确的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故C错误;
D.FeBr2溶液中通入足量氯气,亚铁离子和溴离子都完全被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D正确;
故选D.
B.Cu与浓硝酸的反应,离子方程式中浓硝酸应该写成离子形式,正确的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故B错误;
C.Ca(HCO3)2溶液与过量NaOH溶液反应,反应产物中碳酸根离子过量,正确的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故C错误;
D.FeBr2溶液中通入足量氯气,亚铁离子和溴离子都完全被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D正确;
故选D.
点评:本题考查了离子方程式的正误判断,属于中等难度的试题,注意明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等),选项C为易错点,注意反应物过量情况.

练习册系列答案
相关题目
下列气体可用同一装置制取和收集的是( )
| A、H2和SO2 |
| B、H2 和 C2H2 |
| C、NH3 和C2H4 |
| D、Cl2 和C2H4 |
打开如图所示装置中的止水夹,一段时间后,可能观察到的现象是( )


| A、烧杯中有气泡产生 |
| B、试管内有黄绿色气体产生 |
| C、铁丝网的表面产生锈迹 |
| D、烧杯内溶液变红色 |
决定化学反应速率的主要因素是( )
| A、反应物的浓度 |
| B、反应体系内的压强 |
| C、反应物的性质 |
| D、反应物的状态 |
现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和甘油 ③溴化钠和单质溴的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是( )
| A、分液、萃取、蒸馏、萃取 |
| B、萃取、蒸馏、分液、萃取 |
| C、分液、蒸馏、萃取、蒸馏 |
| D、蒸馏、萃取、分液、萃取 |
下列有关物质性质、应用的说法中正确的是( )
| A、SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 |
| B、浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、自来水厂可用明矾对水进行消毒杀菌 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系 .下列有关物质的推断不正确的是( )
.下列有关物质的推断不正确的是( )
 .下列有关物质的推断不正确的是( )
.下列有关物质的推断不正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为SO2,则丁可能是氨水 |
| C、若甲为AlCl3,则丁可能是浓氨水 |
| D、若甲为NaOH 溶液,则丁可能是CO2 |
已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,
下列叙述中,正确的是( )
| 溶质的质量分数 | 甲溶液密度╱g?cm-3 | 乙溶液密度╱g?cm-3 |
| 1% | 0.95 | 1.02 |
| 5% | 0.92 | 1.04 |
| 9% | 0.90 | 1.07 |
下列叙述中,正确的是( )
| A、混合后,甲、乙溶液中溶质的质量分数均大于5% |
| B、混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5% |
| C、混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5% |
| D、混合后,甲、乙溶液中溶质的质量分数均等于5% |
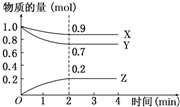 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答: