题目内容
将一定量的锌与100mL 18.5mol?L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L 测得溶液中氢离子的浓度为0.1mol?L-1,
求:(1)气体A中各成分气体的体积比.
(2)反应中共消耗锌多少克?
求:(1)气体A中各成分气体的体积比.
(2)反应中共消耗锌多少克?
考点:化学方程式的有关计算
专题:计算题
分析:浓硫酸与锌反应生成二氧化硫气体,随着反应的进行,硫酸的浓度逐渐降低,继续与锌反应生成氢气,所以33.6L气体为二氧化硫和氢气的混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答:
解:生成气体的物质的量为
=1.5mol,
溶液剩余硫酸的物质的量为
=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,
随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
,
解之得:x=0.3mol、y=1.2mol,
(1)V(SO2):V(H2)=(0.3mol×22.4L/mol):(1.2mol×22.4L/mol)=1:4;
答:气体A中V(SO2):V(H2)=1:4;
(2)m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,
答:反应中共消耗锌97.5g.
| 33.6L |
| 22.4L/mol |
溶液剩余硫酸的物质的量为
| 1L×0.1mol/L |
| 2 |
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,
随着反应的进行,硫酸的浓度逐渐减小,设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
|
解之得:x=0.3mol、y=1.2mol,
(1)V(SO2):V(H2)=(0.3mol×22.4L/mol):(1.2mol×22.4L/mol)=1:4;
答:气体A中V(SO2):V(H2)=1:4;
(2)m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,
答:反应中共消耗锌97.5g.
点评:本题考查方程式的相关计算,为高频考点,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该,题目难度不大.

练习册系列答案
相关题目
分子式为C10H14的苯的同系物,其苯环上有4个甲基,符合条件的结构有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列装置中,电流计G中有电流通过的是( )
A、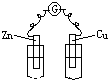 稀H2SO4 |
B、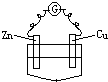 乙醇 |
C、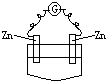 稀H2SO4 |
D、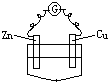 CuSO4溶液 |
某同学在实验报告中有以下实验数据( )
| A、用托盘天平称取11.70g食盐 |
| B、用广泛pH 试纸测得溶液的pH 值是3.2 |
| C、用量筒量取5.26mL盐酸 |
| D、用滴定管取出21.10mL NaOH溶液 |

 化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.
化学学科中的平衡理论包括:化学平衡、电离平衡、溶解平衡等,且均符合勒夏特列原理.请回答下列问题.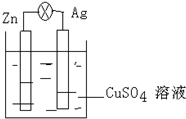 在银锌原电池中,以硫酸铜为电解质溶液.
在银锌原电池中,以硫酸铜为电解质溶液.