题目内容
15.实验室里用如图仪器和药品来制取纯净的无水氯化铜.图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)( ③)接⑤接④接②接( ①)接⑥,其中②与④装置相连时,玻璃管接口应是C接B(用装置中字母表示).
(2)装置②的作用是干燥氯气;装置④的作用是除去氯气中混有的氯化氢.
(3)实验开始时,应首先检验装置的检验装置气密性,实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)在装置①中的实验现象是有大量的棕黄色的烟产生.
(6)用离子方程式表示F中NaOH溶液的作用Cl2+2OH-=Cl-+ClO-+H2O.
分析 利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水汽,需要除去后得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气的尾气对环境有污染,需要用氢氧化钠溶液除去,
(1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,据此答题;
(2)因需要干燥的氯气与铜反应,故利用浓硫酸对氯气进行干燥处理;氯气中混有氯化氢气体,可利用饱和食盐水除去;
(3)实验中涉及气体的,实验开始时一般都要检验装置气密性,为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再能一会儿氯气;
(4)装置⑤是实验室制取氯气,在烧瓶中发生反应的是浓盐酸和二氧化锰,可写出此反应的化学方程式;
(5)铜与氯气在加热条件下反应会生成氯化铜是棕黄色的烟;
(6)F是尾气处理,吸收多余的氯气,氯气与氢氧化钠反应生成氯化钠和次氯酸钠,根据电荷守恒书写离子方程式.
解答 解:利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水汽,需要除去后得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气的尾气对环境有污染,需要用氢氧化钠溶液除去,
(1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,其中②与④装置相连时,玻璃管接口应是C接B,
故答案为:⑤、④、②、⑥;C、B;
(2)装置②中盛装的是浓硫酸,可利用此装置干燥氯气,装置④中盛装的是饱和食盐水可以除去氯气中的氯化氢,
故答案为:干燥氯气;除去氯气中混有的氯化氢;
(3)实验中涉及气体的,实验开始时一般都要检验装置气密性,为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再通一会儿氯气至硬质玻璃管冷却,所以实验结束时,应先熄灭①处的酒精灯,
故答案为:检验装置气密性;①;
(4)装置⑤是利用二氧化锰和浓盐酸混合加热制氯气,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)铜与氯气在加热条件下反应会生成氯化铜是棕黄色的烟,所以可以观察到的现象是有大量的棕黄色的烟产生,
故答案为:有大量的棕黄色的烟产生;
(4)F中氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了常见气体的制取和收集及实验的注意事项,氯化铁的性质和制取;关键是掌握其选择的依据及原理,在装置的分析中明确装置的特点及其作用,难度较大.



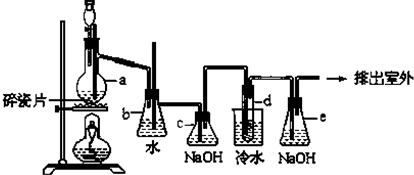
 Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.
Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.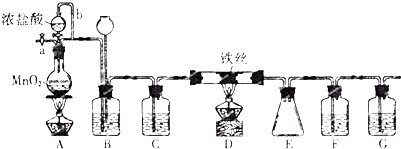


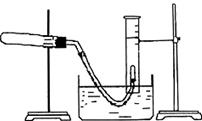 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题: