题目内容
20.某温度时,2NO(g)+O2(g)═2NO2(g)反应到2s后,NO的浓度减少了0.06mol•L-1,则以O2表示该时段的化学反应速率是( )| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2).
解答 解:2s后,NO的浓度减少了0.06mol•L-1,则v(NO)=$\frac{0.6mol/L}{2s}$=0.3mol/(L.s),速率之比等于化学计量数之比,v(O2)=$\frac{1}{2}$v(NO)=0.15mol/(L.s),故选B.
点评 本题考查化学反应速率计算,比较基础,常用定义式法与速率规律进行计算,注意根据速率定义式理解速率规律,

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
14.将1.0g钠、铝混合物投人足量水中充分反应,则产生H2的物质的量为(已知Na、Al物质的量相等)( )
| A. | $\frac{10}{23}$mol | B. | 1mol | C. | $\frac{1}{46}$mol | D. | $\frac{1}{25}$mol |
8.下列热化学方程式书写正确的是( )
| A. | C(s)+O2(g)═CO2(g);△H=+393.5kJ•mol-1 | |
| B. | 2SO2+O2═2SO3;△H=-196.6kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6KJ | |
| D. | H2(g)+1/2O2(g)═H2O(l);△H=-285.8kJ•mol-1 |
15.下列实验操作或做法正确的是( )
| A. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液小火加热蒸干 | |
| B. | 配制100ml1.00mol/L的NaCl溶液,需用托盘天平准确称量5.9g氯化钠固体 | |
| C. | 利用蒸馏的方法进行乙醇与水的分离时,温度计水银球应放在液面以下来准确测定温度 | |
| D. | 用浓硫酸配制一定物质的量的浓度的稀硫酸时,向浓硫酸中加水稀释,冷却至室温后才能够移到容量瓶 |
5.下列表示钠原子的式子中能反映能级差别和电子自旋状态的是( )
| A. |  | B. | $\stackrel{23}{11}$Na | ||
| C. | 1s22s22p63s1 | D. | 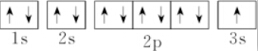 |
12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气通入足量水中,反应生成的HClO分子数为NA | |
| B. | 1mol硝基与NA个二氧化氮气体分子所含电子数相等 | |
| C. | 在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2该反应共转移的电子数为6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含阳离子数小于NA |
9.已知1g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,则下列甲烷燃烧的热化学方程式正确的是( )
| A. | CH4+2O2═CO2+2H2O;△H=-889.6 kJ•mol-1 | |
| B. | CH4 (g)+2O2 (g)═CO2 (g)+2H2O (g);△H=-889.6kJ•mol-1 | |
| C. | CH4 (g)+2O2 (g)═CO2 (g)+2H2O ( l );△H=889.6kJ•mol-1 | |
| D. | CH4(g)+2O2 (g)═CO2 (g)+2H2O ( l );△H=-889.6kJ•mol-1 |
10. 2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )
2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )
 2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )
2005年2月,我国政府就含有添加“苏丹红一号“色素的食品可能诱发癌症发出警告,并全面清剿苏丹红.“苏丹红一号“结构简式如图.有关“苏丹红一号“的下列叙述中不正确的是 ( )| A. | 分子式为C16H12N2O | |
| B. | 能与浓溴水发生取代反应 | |
| C. | 能与氯化铁溶液作用使溶液呈紫色 | |
| D. | 因苏丹红一号中含有酚羟基,故可被空气氧化产生醛基 |
