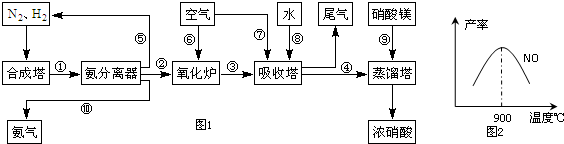
题目内容
在稀溶液中1mol H2SO4与足量NaOH反应放热114.6kJ,表示该中和热的热化学方程式为 .
考点:热化学方程式,中和热
专题:
分析:根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
解答:
解:稀溶液中1mol H2SO4与足量NaOH反应放热114.6kJ,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查中和热以及热化学方程式的书写问题,本题难度中等,注意准确理解中和热的概念.

练习册系列答案
相关题目
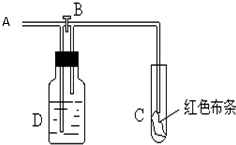 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )| A、D中可能是浓硫酸 |
| B、通入的氯气含有水蒸气 |
| C、D中可能是水 |
| D、D中不可能是NaOH溶液 |



 )
)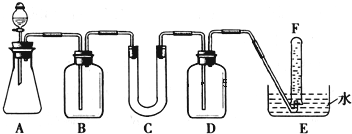
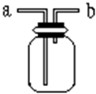 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.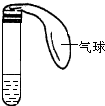 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是