题目内容
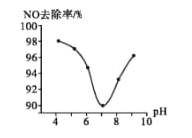
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:
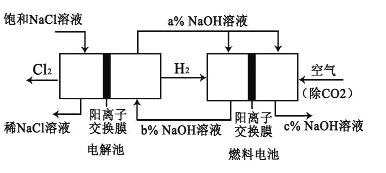
(1)电解池的阴极反应式为_____________。
(2)通入空气一极的电极反应式为_____________。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________LO2。
(4) a、b、c 由大到小的顺序为:_____________。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________
【答案】2H++2e-=H2↑ 正极 从左向右 22.4 c>a> 2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O
【解析】
(1) 电解池中生成氢气的一端为电解池的阴极,溶液中氢离子得到电子生成氢气;
(2) 燃料电池中燃料在原电池负极失电子发生氧化反应,空气中氧气在正极上得到电子生成氢氧根离子,燃料电池中阳离子移向正极;
(3) 依据电解池和原电池中电子守恒计算得到;
(4)燃料电池中正极氧气得到电子产生OH-,负极氢气失电子生成氢离子消耗氢氧根离子,再结合离子交换膜的作用分析即可;
(5) 二氧化氯由KClO3在H2SO4存在下与Na2SO3反应制得,则可知反应物、生成物,结合电子守恒、电荷守恒分析。
(1) 电解池中生成氢气的一端为电解池的阴极,溶液中氢离子得到电子生成氢气,在氢氧化钠溶液中,电解池的阴极反应式为;2H++2e-=H2↑;
(2) 燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,即H2-2e-+2OH-=2H2O,正极是氧气发生得电子得还原反应,即O2+4e-+2H2O=4OH-,铜空气的电极为正极;原电池中,阳离子交换膜使阳离子通过,阳离子移向正极;
(3) 电解池中产生2mol Cl2,依据电子守恒,O2+4e-+2H2O=4OH-,4Cl--4e-=2Cl2↑,得到2Cl2~O2,计算得到生成氧气1mol,标准状况下O2的体积为1mol×22.4L/mol=22.4L;
(4) 燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于c%,负极氢气失电子生成氢离子消耗氢氧根离子,所以b%<a%,得到b%<a%<c%,故答案为:c>a>b;
(5) KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
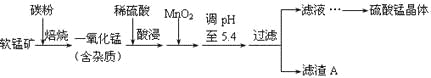
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,并探究溴乙烷的性质。反应原理和实验装置如下(加热装置未画出):
H2SO4(浓)+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O

有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
Ⅰ.溴乙烷的制备:
(1)若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,其化学方程式为__________;F连接导管通入稀NaOH溶液中,其目的主要是_________;导管E的末端须低于D的水面,其目的是__________。
(2)为了除去粗产品中的氧化性杂质,宜选择下列_________ (填序号)溶液来洗涤所得粗产品。
A.氢氧化钠 B.碘化钾 C.碳酸氢钠 D.亚硫酸钠
(3)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是___________。
Ⅱ.溴乙烷性质的探究
用如图乙实验装置(铁架台、酒精灯略)验证溴乙烷的性质:在试管中加入10mL6mol·L1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。
(4)观察到___________,表明溴乙烷与NaOH溶液已完全反应。
(5)为证明溴乙烷在NaOH乙醇溶液中反应的气体产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是 ___________,若无a试管,b试管中的试剂应为___________ 。