题目内容
【题目】氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是______,这三种化台物中N原子的杂化类型是______,分子的空间构型是______
(2)N、F、Br三种元素的电负性由大到小顺序为____________
(3)叠氮酸(HN3)是一种弱酸。可部分电离出H+和N3-,请写出两种与N3-互为等电子体的分子______
(4)Fe2+、Cu2+、Co3+等过渡金属离子都能与叠氮化物、氰化物形成配合物。Fe2+的核外电子排布式为______;配合物[Co(N3)(NH3)5]SO4中Co的配位数为______,Co3+与NH3之间的作用力是______
(5)NaN3与KN3相比,NaN3的晶格能______KN3的晶格能(填“>”、“=”或“<”)+
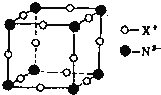
(6)某元素X与N形成的氮化物中,X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示,X+的符号是______,晶体中每个N3-与其距离最近的X+有______个。
【答案】NBr3>NCl3>NF3 sp3杂化 三角锥形 F>N>Br N2O或CO2或CS2或BeCl2(任写两种) 1s22s22p63s23p63d6或[Ar]3d6 6 配位键 > Cu+ 6
【解析】
(1)根据分子晶体熔沸点的比较方法进行分析;计算中心原子的价电子对数可判断出中心原子杂化方式及分子空间构型;
(4)根据配合物[Co(N3)(NH3)5]SO4的结构判断配位数和作用力;
(5)根据钠离子和钾离子的半径可比较出NaN3与KN3的晶格能大小;
(6)根据X的核外电子排布特点推导出X元素的种类,再利用晶体结构图,看出晶体中每个N3-与其距离最近的X+的个数。
(1)NF3、NBr3、NCl3都是分子晶体,且组成结构相似,它们的相对分子质量的大小关系为:NBr3>NCl3>NF3,所以它们的沸点由高到低的顺序是:NBr3>NCl3>NF3;在这三种化合物中,每个氮原子都和其它三个原子形成3个σ键,另外还有一对孤电子对,所以氮原子均采取sp3杂化,由于有一对孤电子对,所以它们都是三角锥形,故答案为:NBr3>NCl3>NF3;sp3杂化;三角锥形;
(2)F的电负性最大,N与Cl电负性相当,Br的电负性比Cl的电负性小,则N、F、Br三种元素的电负性由大到小顺序为F>N>Br;
(3)N3-中有三个原子,价电子总数为16,根据等电子体原理可知,与它互为等电子体的分子有:N2O、CO2、CS2、BeCl2,故答案为:N2O或CO2或CS2或BeCl2(任写两种);
(4)铁为26号元素,Fe2+的核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,在配合物[Co(N3)(NH3)5]SO4中,一个N3-和5个NH3都是配体,分别与钴离子形成配位键,所以钴离子的配位数是6,Co3+与NH3之间的作用力是配位键;
(5)因为钠离子的半径比钾离子的半径小,所以NaN3的晶格能比KN3的晶格能大;
(6)X+中K、L、M三个电子层均充满了电子,所以X+核外有28个电子,即X为铜元素,X+为Cu+,根据晶体结构图可知,每个N3-与其距离最近的Cu+有6个。

【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应