题目内容
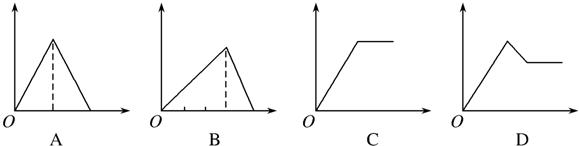
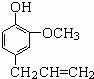
5.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝 会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.
解答 解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH-═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH-═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH-═AlO2-+2H2O,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
点评 理清反应的整个过程,问题即可解决,即可利用方程式也可根据关系式,本题采取原子守恒计算.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
13.依据下列事实或实验得出结论正确的是( )
| 选项 | 事实或实验 | 结论 |
| A | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| B | 向某溶液中滴加氯水,再加入KSCN溶液,溶液呈红色 | 原溶液中一定含有Fe2+ |
| C | 汽车尾气净化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△S<0 | 该反应在常温不能自发进行 |
| D | 向NaBr溶液中滴入少量氯水和CCl4,振荡,静置溶液下层呈红色 | Br-还原性强于Cl- |
| A. | A | B. | B | C. | C | D. | D |
20.下列离子方程错误的是( )
| A. | 碳酸氢钠溶液和氢氧化钠溶液混合 HCO3-+OH-═CO32-+H2O | |
| B. | 向氯化铁溶液中投入铜粉 Cu+Fe3+═Fe2++Cu2+ | |
| C. | 少量的二氧化碳通入次氯酸钙溶液 Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| D. | 铜与稀硝酸反应 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
10.下列物质按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是( )
| A. | 纯盐酸X、Y、水煤气、硫酸、醋酸、干冰 | |
| B. | 冰醋酸、福尔马林、硫酸钡、氢氟酸、氯气 | |
| C. | 单甘油脂、混甘油脂、苛性钾、氢硫酸、三氧化硫 | |
| D. | 胆矾、漂白粉、氯化钾、次氯酸、乙醇 |
17.X、Y、Z 均为短周期元素,X、Y 处于同一周期,X、Z 的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 气态氢化物的稳定性:HX>HZ | B. | 原子半径:Y>X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 元素的最高化合价:Z>X>Y |

 丁子香酚存在于丁香油、樟脑油等中,常用于配制康乃馨型香精以及制异丁香酚和香兰素等,也用作杀虫剂和防腐剂.丁子香酚结构简式如图:
丁子香酚存在于丁香油、樟脑油等中,常用于配制康乃馨型香精以及制异丁香酚和香兰素等,也用作杀虫剂和防腐剂.丁子香酚结构简式如图: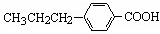 、
、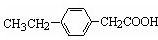 .
.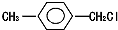 和乙醇为原料制备丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯的合成路线(无机试剂任选).
和乙醇为原料制备丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯的合成路线(无机试剂任选).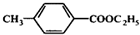

 .
. .
. (聚丁二酸乙二酯)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
(聚丁二酸乙二酯)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.