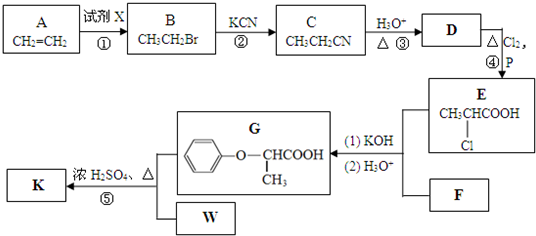
题目内容
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度或“0“刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
③将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol?L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度“0“刻度以下的位置,记下读数.
④向锥形瓶中滴入指示剂,进行滴定.滴定至终点,记录数据.
⑤重复以上过程2次.
试回答下列问题:(1)应将NaOH溶液注入如图1中的
(2)该小组在实验步骤中的错误是
(3)如图2是某次滴定时的滴定管中的液面,如图2表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL)[ | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
考点:中和滴定
专题:
分析:(1)NaOH溶液注入碱式滴定管,碱式滴定管尖嘴部分为橡皮管;
(2)碱式滴定管用蒸馏水洗净,要用待测液润洗2-3次,再注入待测溶液,否则,待测液浓度降低;
(3)滴定管中0刻度在上方,读数时精确到0.01mL;
(4)首先求出平均消耗标准液盐酸的体积,据c(待测)=
求算.
(2)碱式滴定管用蒸馏水洗净,要用待测液润洗2-3次,再注入待测溶液,否则,待测液浓度降低;
(3)滴定管中0刻度在上方,读数时精确到0.01mL;
(4)首先求出平均消耗标准液盐酸的体积,据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)NaOH溶液注入碱式滴定管,碱式滴定管尖嘴部分为橡皮管,故答案为:乙;
(2)错误操作为①,碱式滴定管用蒸馏水洗净,要用待测液润洗2-3次,再注入待测溶液,否则,待测液浓度降低,故答案为:①;偏低;
(3)滴定管中0刻度在上方,读数时精确到0.01mL,A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,故答案为:25.40;
(4)平均消耗标准液盐酸的体积为
=25.00mL,c(待测)=
=
=0.1250mol/L,
故答案为:0.1250mol/L.
(2)错误操作为①,碱式滴定管用蒸馏水洗净,要用待测液润洗2-3次,再注入待测溶液,否则,待测液浓度降低,故答案为:①;偏低;
(3)滴定管中0刻度在上方,读数时精确到0.01mL,A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,故答案为:25.40;
(4)平均消耗标准液盐酸的体积为
| 24.90mL+25.10mL |
| 2 |
| c(标准)×V(标准) |
| V(待测) |
| 25.00mL×0.1000mol/L |
| 20.00mL |
故答案为:0.1250mol/L.
点评:本题考查了酸碱中和滴定中的操作、计算和误差分析,注意中和滴定操作的误差分析,根据c(待测)=
分析是解答的关键,题目难度中等.
| c(标准)×V(标准) |
| V(待测) |

练习册系列答案
相关题目
燃烧某混合气体,所产生的CO2的质量一定大于燃烧同质量丙烯所产生的CO2的质量,该混合气体是( )
| A、丁烯、丙烷 |
| B、乙炔(C2H2)、乙烯 |
| C、乙炔、丙烷 |
| D、乙烷、环丙烷 |
下列化学用语表达正确的是( )
A、碳-12原子
| ||
B、N2电子式 | ||
| C、次氯酸的结构式 H-Cl-O | ||
D、硫离子结构示意图 |
用标准的氢氧化钠溶液(指示剂为酚酞)滴定某未知浓度的盐酸,以下操作造成测定结果偏低的是( )
| A、配制标准溶液所用的氢氧化钠已经潮解 |
| B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C、未用标准液润洗碱式滴定管 |
| D、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
NaCl溶液中混有Na2S和NaI,为了除去杂质,并将杂质逐一分离,选用如下操作:
①通入Cl2;②加碘水;③用CCl4萃取;④过滤;⑤分液.其操作顺序正确的是( )
①通入Cl2;②加碘水;③用CCl4萃取;④过滤;⑤分液.其操作顺序正确的是( )
| A、①②③④⑤ |
| B、②④①③⑤ |
| C、④⑤③②① |
| D、⑤②①④③ |
 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.