题目内容
13.现有标准状况下的HCl气体6.72L,将其溶于水配成500mL的盐酸溶液,求(1)该气体的物质的量为多少?(须写出计算步骤,下同)
(2)该气体的质量为多少?
(3)该盐酸中溶质的物质的量浓度为多少?
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$=cV计算相关物理量.
解答 解:(1)n=$\frac{6.72L}{22.4L/mol}$=0.3mol,答:该气体的物质的量为0.3mol;
(2)m=0.3mol×36.5g/mol=10.95g,答:该气体的质量为10.95g;
(3)c=$\frac{0.3mol}{0.5L}$=0.6mol/L,答:该盐酸中溶质的物质的量浓度为0.6mol/L.
点评 本题考查阿伏伽德罗定律及其推论,为高频考点,明确各个物理量之间关系是解本题关键,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
8.与0.3mol CH4 含有相同氢原子数的是( )
| A. | 0.3 mol HNO3 | B. | 3.01×10 23个 H2O分子 | ||
| C. | 3.4 g H2S | D. | 8.96L NH3(标准状况下) |
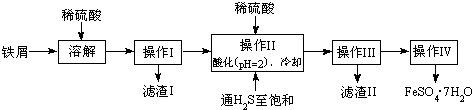
18.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如表:
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;.
(2)操作II中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)已知常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:0.6×10-14(保留1位小数)
(6)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.计算上述样品中FeSO4•7H2O的质量分数为97.5%.(保留3位小数)

查询资料,得有关物质的数据如表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作II中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)已知常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:0.6×10-14(保留1位小数)
(6)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.计算上述样品中FeSO4•7H2O的质量分数为97.5%.(保留3位小数)
19.关于化学键的叙述正确的是( )
| A. | 离子化合物中只存在离子键 | |
| B. | 非金属元素组成的化合物中可能存在离子键 | |
| C. | 由不同种元素组成的多原子分子里,一定只存在极性共价键 | |
| D. | 含金属元素的化合物中一定存在离子键 |
 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.