题目内容
18. 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
分析 A.图中反应物比生成物能量的低;
B.正逆反应活化能之差等于反应热;
C.正逆反应活化能之差等于反应热;
D.逆反应的活化能为E2,正反应的活化能E1,结合图分析.
解答 解:A.图象中反应物能量低于生成物能量,故反应是吸热反应,故A错误;
B.因为正逆反应活化能之差不变,催化剂降低了反应的活化能,即正反应活化能减小,逆反应活化能也减小,反应的焓变不变,故B错误;
C.因为正逆反应活化能之差不变,催化剂降低了反应的活化能,即正反应活化能减小,逆反应活化能也减小,催化剂能改变反应的路径,故C正确;
D.逆反应的活化能为E2,正反应的活化能E1,△H=E1-E2,故D错误;
故选C.
点评 本题考查了化学反应的能量变化,明确催化剂的作用实质是解题的关键,注意把握图象识别和理解含义,题目难度不大.

练习册系列答案
相关题目
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐在低温碱性环境中稳定,易溶于水,难溶于无水乙醇等有机溶剂.
常见高铁酸钾的制备方法如下:
(1)干法制备反应中氧化剂和还原剂的物质的量之比为:3:1.
(2)某湿法制备高铁酸钾的基本流程及步骤如下:

①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是 .
.

常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:

①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
 .
.
3.下列说法或表示错误的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
10.实验室采用简易装置模拟演示工业炼铁原理.实验装置图和实验步骤如下:
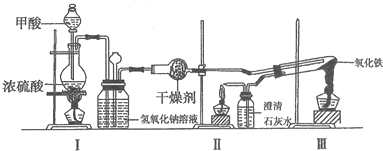
①按如图连接好装置,检查装置气密性.
②称取适量Fe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下分解,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式为HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③“某项操作”是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(用“I”、“Ⅱ”、“Ⅲ”表示)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃时,Fe能稳定存在,在680~710℃之间时,FeO能稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因:长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
分析各元素的质量分数可知前两种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有9种可能.
(6)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式所得混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数).

①按如图连接好装置,检查装置气密性.
②称取适量Fe2O3于石英试管中,点燃I处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下分解,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式为HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③“某项操作”是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(用“I”、“Ⅱ”、“Ⅲ”表示)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃时,Fe能稳定存在,在680~710℃之间时,FeO能稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因:长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4中氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前两种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式所得混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数).
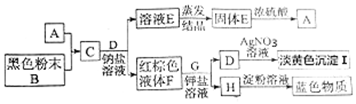
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.
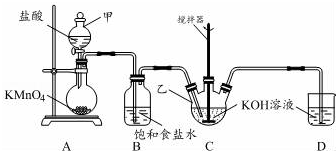 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4. 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.