题目内容
1.下列叙述不正确的是( )| A. | Na+、Mg2+、Al3+ 的氧化性依次减弱 | |
| B. | HI、HBr、HCl 的还原性的依次减弱 | |
| C. | H2S、H2O、HF的热稳定性依次增强 | |
| D. | O2-、F-、Na+、Br-的半径大小顺序为:Br->O2->F->Na+ |
分析 A.同周期从左向右金属性减弱,对应金属阳离子的氧化性增强;
B.同主族从上到下非金属性减弱,对应氢化物的还原性增强;
C.非金属性越强,对应氢化物越稳定;
D.电子层越多,离子半径越大;具有相同电子排布的离子中原子序数大的离子半径小.
解答 解:A.同周期从左向右金属性减弱,对应金属阳离子的氧化性增强,则Na+、Mg2+、Al3+ 的氧化性依次增强,故A错误;
B.同主族从上到下非金属性减弱,对应氢化物的还原性增强,则HI、HBr、HCl 的还原性的依次减弱,故B正确;
C.非金属性S<O<F,则H2S、H2O、HF的热稳定性依次增强,故C正确;
D.电子层越多,离子半径越大;具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为Br->O2->F->Na+,故D正确;
故选A.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
20.如图有关实验原理、操作或现象不正确的是( )
| A. |  可制得金属锰,用同样的装置可制得金属铬 | |
| B. |  制取少量氨气 | |
| C. |  除去Cl2中的少量HCl | |
| D. |  制乙酸乙酯 |
12.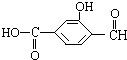 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
16.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O3 | D. | C14H10O3 |
13.在恒温恒容的容器中进行反应N2(g)+3H2(g)?2NH3(g),若起始c(N2)=0.1mol•L-1,4s后c(N2)=0.02mol•L-1需,那么前两秒内v(NH3)可能为( )
| A. | 0.02mol/(L•s) | B. | 0.04mol/(L•s) | C. | 0.06mol/(L•s) | D. | 0.03mol/(L•s) |
10.下列不能和铁发生反应的是( )
| A. | H+ | B. | OH- | C. | Fe3+ | D. | 氯水 |
11.一定温度下,可逆反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时生成3mol B2 | |
| C. | 容积一定时,容器内气体密度保持不变 | |
| D. | 容器内A2、B2、AB3的物质的量浓度相等 |
