题目内容
15.100mL 1mol•L-1Al2(SO4)3溶液中含SO42-离子0.3NA或1.806×1023个,含Al3+离子0.2mol.分析 根据n=cV计算出硫酸铝的物质的量,然后根据硫酸铝的化学式组成计算出铝离子、硫酸根离子的物质的量,最后根据N=nNA计算出硫酸根离子的数目.
解答 解:100mL 1mol•L-1Al2(SO4)3溶液中含有硫酸铝的物质的量为:1mol/L×0.1L=0.1mol,0.1mol Al2(SO4)3中含有硫酸根离子的物质的量为:0.1mol×3=0.3mol,含有铝离子的物质的量为:0.1mol×2=0.2mol;含有硫酸根离子的数目为0.3NA或1.806×1023,
故答案为:0.3NA或1.806×1023;0.2.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})•c(CO)}$,△H<0(填“>”、“<”或“=”).
②按下列物质的量发生反应,CO的转化率由大到小的顺序是甲>丙>乙(填甲乙丙).
(2)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l)K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}•{{K}_{3}}^{2}}{{{K}_{2}}^{\frac{1}{2}}}$(用含有K1,K2,K3的代数式表达)
2H2(g)+CO(g)?CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②按下列物质的量发生反应,CO的转化率由大到小的顺序是甲>丙>乙(填甲乙丙).
| 编号 | C(H2)mol/L | C(CO)mol/L |
| 甲 | 2 | 1 |
| 乙 | 1 | 2 |
| 丙 | 1 | 1 |
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l)K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}•{{K}_{3}}^{2}}{{{K}_{2}}^{\frac{1}{2}}}$(用含有K1,K2,K3的代数式表达)
6.等质量的氯气与下列足量物质反应,转移的电子数最少的是( )
| A. | SO2的水溶液 | B. | FeCl2溶液 | C. | 冷的NaOH溶液 | D. | Cu |
3.下列说法正确的是( )
| A. | 平衡膳食就是各种食物都要吃 | |
| B. | 摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构 | |
| C. | 淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可以了 | |
| D. | 麦芽糖不可以水解 |
20.化学在生产和生活中有着重要的应用.下列说法不正确的是( )
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制得金属镁 | |
| C. | 在海轮的外壳镶上锌块,可减缓船体的腐蚀速率 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
7.用括号内试剂除去下列各物质中的少量杂质,正确的是( )
| A. | 溴苯中的溴(苯) | |
| B. | MgCl2酸性溶液中少量的FeCl3(Mg(OH)2) | |
| C. | 硝基苯中的苯(硝酸) | |
| D. | 甲烷中的乙烯(酸性高锰酸钾溶液) |
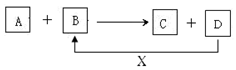 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.